
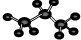


| A. | ①④ | B. | ①②④ | C. | ②③④ | D. | ②③ |
分析 ①次氯酸中Cl只能形成一个共价单键;
②球棍模型中,棍表示化学键,球表示原子的大小;
③硫化氢分子的结构与水分子类型,为 V型结构;
④在Mg18O晶体中,阴离子为氧离子,氧离子核外有10个电子,有2个电子层,最外层电子数为8.
解答 解:①次氯酸分子中存在1个氢氧键和1个氧氯键,其结构式为:H-O-Cl,故①错误;
②丙烷的分子球棍模型中,棍表示化学键,大球表示碳原子、小球表示氢原子,丙烷的分子球棍模型示意图: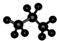 ,故②正确;
,故②正确;
③硫化氢分子中存在两个S-H键,为V型结构,所以H2S分子的比例模型为: ,故③正确;
,故③正确;
④氧离子核外有10个电子,有2个电子层,最外层电子数为8,结构示意图为 ,故④正确;
,故④正确;
故选C.
点评 本题考查了化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及表示方法,明确球棍模型与比例模型的表示方法是解答关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 大量建设水电站,用电力分解水制取氢气 | |
| B. | 利用核能,使水分解产生氢气 | |
| C. | 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气 | |
| D. | 寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将人群转移到地势较低的地方,等待营救 | |
| B. | 人群顺风逃跑 | |
| C. | 用高压水枪向空中喷洒大量碱性溶液 | |
| D. | 被转移人群可戴上用NaOH处理过的口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com