
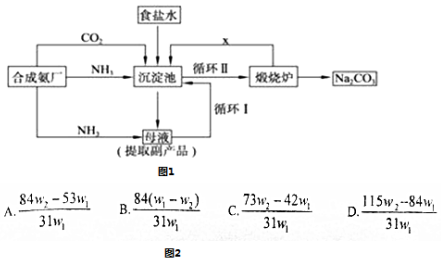
分析 (1)氨气极易溶于水,二氧化碳在水中的溶解度较小;
(2)联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,沉淀池中得到的为碳酸氢钠,加热分解生成碳酸钠、水和CO2;
(3)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;高温下,碳酸氢钠不稳定易分解;
(4)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,利用反应前后固体的质量差、结合差量法来计算碳酸氢钠的质量,再计算碳酸钠样品的纯度.
解答 解:(1)二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳,故答案为:NH3;
(2)在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故答案为:CO2;
(3)在沉淀池氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、水和二氧化碳,反应方程式为 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)设样品中含有NaHCO3杂质的质量为x,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O?质量减少△m
2×84 106 62
x (w1g-w2g)
所以2×84:62=x:(w1g-w2g)
解得x=$\frac{84({W}_{1}-{W}_{2})}{31}$g,
则w(Na2CO3)=1-$\frac{X}{{W}_{1}}$=$\frac{84{W}_{2}-53{W}_{1}}{31{W}_{1}}$,
故选A.
点评 本题考查了实验方案的设计和混合物有关计算,明确物质的性质是解本题关键,了解制备原理,知道常见物质分离的方法,注意根据质量守恒定律理解差量法,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.6 | B. | 0.7 | C. | 0.75 | D. | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20.0gNaOH的稀溶液与足量稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(1)△H=-114.8kJ/mol | |
| B. | 已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ | |
| C. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol | |
| D. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.31kJ•mol-1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)═H2O(1)+BaSO4(s)△H<-57.31kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
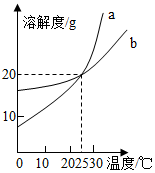
| A. | a的溶解度大于b的溶解度 | |
| B. | 在20℃时,a、b的溶液中溶质的质量分数相同 | |
| C. | b的溶解度都随温度升高而增大 | |
| D. | b都属于易溶物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向两份完全相同Ba(OH)2溶液中分别加入浓度相同的Al2(SO4)3和KAl(SO4)2,产生的沉淀的物质的量随所加溶液体积关系如图.下列分析不正确的是( )
向两份完全相同Ba(OH)2溶液中分别加入浓度相同的Al2(SO4)3和KAl(SO4)2,产生的沉淀的物质的量随所加溶液体积关系如图.下列分析不正确的是( )| A. | a、d两点的沉淀为BaSO4 | B. | b、c两点溶液的导电能力相同 | ||
| C. | b、c两点溶液的PH值相同 | D. | d点溶液中大量存在的阳离子是K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com