
【题目】由乙烯推测丙烯的结构或性质,正确的是( )
A. 不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
B. 分子中所有原子都在同一平面上
C. 与HCl加成只生成一种产物
D. 由丙烯之间的相互加成可得聚丙烯
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.向血红色的Fe(SCN)3溶液中加入少量KI 固体,溶液颜色变浅
B.氨水溶液加水稀释,c(OH-)增大,平衡常数增大
C.pH=12的NaOH和Na2S溶液中水的电离程度前者大于后者
D.25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO3)2溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究称癌症导致的死亡率呈逐年上升的趋势,目前是仅次于心血管疾病的第二大杀手。M是一种可用于治疗肿瘤的药物,其合成路线如下

已知:①芳香烃A的相对分子质量在86-96之间:F能使溴水褪色。
②J与 NaHCO3溶液反应放出CO2气体,核磁共振氢谱显示其有3个吸收峰。
③ ④M的结构简式为
④M的结构简式为
回答下列问题:
(1)A的化学名称为________________ , ④的反应类型是_____________.
(2)D分子中所含官能团的名称为_________________________。
(3)②的反应方程式为________________,⑤的反应方程式为__________________。
(4)N(C7H7NO2)是E在一定条件下的水解产物,符合下列条件的N的同分异构体有_____种。其中核磁共振氢谱有4个峰的结构简式为_________________。
①分子中苯环上直接连一NH2②能发生银镜反应
(5)4-甲氧基乙酰苯胺( )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )和乙酰氯( CH3 COCl)制备4-甲氧基乙酰苯胺的合成路线(无机试剂任选):_____________________________________________________________。
)和乙酰氯( CH3 COCl)制备4-甲氧基乙酰苯胺的合成路线(无机试剂任选):_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN 等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯睛(C3H3N)和副产物丙烯醛(CH2=CHCHO)的热化学方程式如下:
① C3H6(g)+NH3(g)+O2(g)=C3H3N(g)+3H2O(g)△H=-515kJ/mol
② C3H6(g)+O2(g)=C3H4O(g)+H2O(g) △H=-353kJ/mol
有利于提高丙烯腈平衡产率的反应条件是______;提高丙烯腈反应选择性的关键因素是_____.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是_____;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D. 反应活化能增大
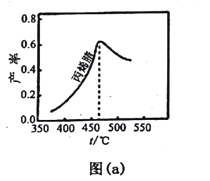
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为_________ ,理由是_______。进料氨、空气、丙烯的理论体积约为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________;
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ ![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ ![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________;
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应: ![]() (aq)+I2(aq)+2OH(aq)
(aq)+I2(aq)+2OH(aq)![]()
![]() (aq)+2I(aq)+ H2O(l)。溶液中c(
(aq)+2I(aq)+ H2O(l)。溶液中c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I)=2v(![]() )
)
c.c(![]() )/c(
)/c(![]() )不再变化 d.c(I)=y mol·L1
)不再变化 d.c(I)=y mol·L1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图-1和题图-2所示:
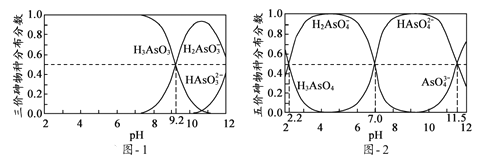
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1);
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1);
(6)溶液的pH对吸附剂X表面所带电荷有影响,pH =7.1时,吸附剂X表面不带电荷;pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题图-3所示:
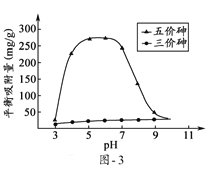
试问,提高吸附剂X对三价砷去除效果可采取的措施是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法正确的是( )
A. 聚乙烯、聚氯乙烯、纤维素都是合成高分子化合物
B. 天然油脂的分子中含有酯基,属于酯类物质
C. 可以用加热的方法分离提纯蛋白质
D. 乙醇、乙酸、乙烯都能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种物质,均含同一种元素,一定条件下其转化关系如下(部分产物已略去):
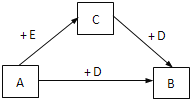
请回答:
(1)若A是短周期元素组成的金属单质,D是短周期中原子半径最大的主族元素形成的氢氧化物。
①组成A的元素在周期表中的位置是_________________。
②当A与D的溶液反应转移1.5 mol电子时,产生气体的体积(标准状况)为____L。
(2)若A是常见金属单质,B的溶液为黄色,D的组成元素的原子M层电子数比L层少1。
①下列关于C的说法正确的是_________(填字母)。
a. 其溶液为无色 b. 遇KSCN溶液变红色
c. 既有氧化性也有还原性 d. 其溶液可用于吸收氯气
②B与HI溶液反应可生成C、E和一种单质,该反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄曲霉素AFTB1,其结构简式如下图所示,它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性。下列说法正确的是

A. 黄曲霉素分子中所有的原子肯定均共面
B. 黄曲霉素分子中含有4个手性碳原子
C. 1mol黄曲霉素最多能与5 mol H2发生加成反应
D. 黄曲霉素可以发生取代、加成、还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com