
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | 氯的各种含氧酸的酸性由强到弱排列为HClO4<HClO3<HClO2<HClO | |
| C. | 元素的性质呈现周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 | |
| D. | 稀有气体一般难于发生化学反应,是由于其键能大 |
分析 A.HF分子之间存在氢键,故熔点沸点相对较高;
B.同一元素若能形成几种不同氧化态的含氧酸,其酸性随化合价递增而递增;
C.根据“结构决定性质”分析;
D.稀有气体为单原子分子,原子都形成稳定结构.
解答 解:A.HF分子之间存在氢键,故熔点沸点相对较高,故熔点沸点的大小关系为HF>HI>HBr>HCl,故A错误;
B.同一元素若能形成几种不同氧化态的含氧酸,其酸性随化合价递增而递增,故酸性为HClO4>HClO3>HClO2>HClO,故B错误;
C.元素原子的核外电子排布呈周期性变化导致元素的性质呈现周期性变化,故C正确;
D.稀有气体为单原子分子,原子都形成稳定结构,稀有气体一般难于发生化学反应,与键能无关,故D错误;
故选C.
点评 本题考查氢键的存在及对物质性质色影响、同一元素形成的不同含氧酸的酸性大小判断,难度不大.要注意氢键对物质熔沸点的影响.


科目:高中化学 来源: 题型:填空题
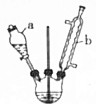 己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:
己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下: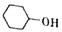 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH3 | B. | 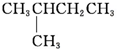 | C. |  | D. | 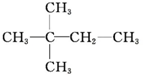 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下: +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$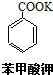 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O 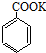 +HCl→
+HCl→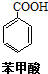 +KCl
+KCl| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
| 甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于5s | B. | 等于10s | C. | 小于10s | D. | 大于10s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池可在常温或高温时工作,对环境有较强的适应性 | |
| B. | 负极反应为H2+2OH--2e-=2H2O | |
| C. | 该电池工作时负极有CO2生成 | |
| D. | 该电池供应2molH2O,同时转移2mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com