
【题目】下列实验操作正确的是![]()
A.用酚酞试纸测定氨的酸碱性时,试纸需用蒸馏水润湿
B.测定中和热的实验中,酸或碱不可过量,否则会产生较大误差
C.中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒
D.用pH试纸测定氯水的pH值为![]()
科目:高中化学 来源: 题型:
【题目】利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O

(1)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨Ⅱ是电池的 极;石墨Ⅰ附近发生的电极反应式为 。
(2)工作时,甲池内的NO3-离子向 极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为 。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为 。
(4)若溶液中减少了0.01 mol Cr2O72-,则电路中至少转移了 mol电子。
(5)向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至 。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是
![]() 在
在![]() ,101KPa条件下,液态水气化热为40.69kJ/mol,则
,101KPa条件下,液态水气化热为40.69kJ/mol,则![]()
![]()
![]() 已知
已知![]() 时,
时,![]() 的
的![]() ,则在该温度下,含有固体
,则在该温度下,含有固体![]() 的溶液中,无论
的溶液中,无论![]() 与
与![]() 是否相等,总有
是否相等,总有![]()
![]() 已知:
已知:
共价键 | C--C |
| C--H | H一H |
键能 | 348 | 610 | 413 | 436 |
则反应![]()
![]()
![]()
![]()
![]() 常温下,在
常温下,在![]() 的
的![]() 溶液中加入少量
溶液中加入少量![]() 晶体,则
晶体,则![]() 电离被抑制,溶液pH减少
电离被抑制,溶液pH减少
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几难溶物质的有关数值如表所示:下列关于含等物质的量的![]() 、
、![]() 、
、![]() 的混合溶液的说法正确的是
的混合溶液的说法正确的是![]()
物质 |
|
|
|
|
|
|
|
完全沉淀时的pH范围 |
|
|
|
A.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀
B.该溶液中![]() :
:![]() :4
:4
C.当![]() 时,溶液中
时,溶液中![]() :
:![]() :1
:1
D.向该溶液中加入适量氨,调节pH到![]() 后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、
后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、![]() 三种固体的混合物
三种固体的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据

(1)该反应的化学方程式为:___。
(2)反应开始至2min,用Z表示的平均反应速率为:___。
(3)下列叙述能说明上述反应达到化学平衡状态的__(填序号):
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入amolX(g)和bmolY(g),发生反应X(g)+Y(g)═2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:__;②恒容通入氦气:___;③使用催化剂:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B. 在0.1 molL﹣1 CH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+)
C. 在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl)
D. 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
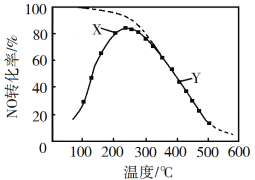
A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com