
| һ������ |

| n(CH3OH) |
| n(CO2) |
| 1 |
| 2 |
| ��c |
| ��t |
| ������ |
| ��ʼ�� |
| 0.75mol/L |
| 10min |
| һ������ |
| 0.75��0.75 |
| 0.25��0.753 |
| 2.25mol/L |
| 3mol/L |
| 1 |
| 2 |
| 1 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
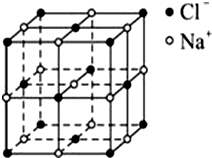
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
6 3 |
14 7 |
23 11 |
24 12 |
7 3 |
14 6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 I��д�������Ȼ�ѧ��Ӧ����ʽ
I��д�������Ȼ�ѧ��Ӧ����ʽ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� ���� |
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
| ���������ml�� | 50 | 120 | 232 | 290 | 310 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
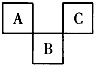 ��ͼ��Ԫ�����ڱ������ڵ�һ���֣�A��C����Ԫ�صĺ��������֮�͵���B�ĺ��������������������ȷ���ǣ�������
��ͼ��Ԫ�����ڱ������ڵ�һ���֣�A��C����Ԫ�صĺ��������֮�͵���B�ĺ��������������������ȷ���ǣ�������| A��AԪ��λ�ڵڶ����ڡ���A�� |
| B��ԭ�Ӱ뾶C��B��A |
| C����һ�������£�A��B����̬�⻯�ﶼ�ܹ���������Ӧ |
| D������Ԫ�ض�������ۺ����ᣬ�Ҷ���ǿ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �ں���4mol HCl��1mol MgSO4�Ļ����Һ����μ���Ba��OH��2��Һ�������ij�������m�����Ba��OH��2���ʵ���n֮��Ĺ�ϵ��ͼ������˵����ȷ���ǣ�������
�ں���4mol HCl��1mol MgSO4�Ļ����Һ����μ���Ba��OH��2��Һ�������ij�������m�����Ba��OH��2���ʵ���n֮��Ĺ�ϵ��ͼ������˵����ȷ���ǣ�������| A��a��bʱ�ij����ijɷ�ΪBaSO4��Mg��OH��2 |
| B��b��cʱ���������ӷ�ӦΪ��H++OH-��H2O |
| C��c��dʱ���ӵ����ʵ�����Ba2+���ܴ���Cl- |
| D��d��eʱ���ӵ����ʵ�����Ba2+һ������OH- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com