

分析 由元素在周期表中位置,可知A为H、B为C、C为N、D为O、E为Cl元素.
(1)Ga元素处于第四周期ⅢA族;
(2)Fe元素处于d区,Fe和CO形成配合物Fe(CO)5,CO为中性分子,利用化合价代数和为0判断Fe的化合价;
(3)价电子数相同和原子数相同的微粒互称等电子体,与CO互为等电子体的分子和离子分别为N2、C22-、CN-;
(4)判断CH4、CO、CH3OH中C原子价层电子对数,确定其杂化方式;
(5)ED4-是ClO4-离子,价层电子对数=σ键数目+中心原子上的孤电子对数,进而确定其空间结构;
若化合价的绝对值+原子最外层电子数=8,分子中每个原子最外层都达到8电子稳定结构.
解答 解:由元素在周期表中位置,可知A为氢、B为碳、C为氮、D为氧、E为Cl.
(1)Ga元素处于第四周期ⅢA族,其最外层电子排布式为4s24p1;
故答案为:4s24p1;
(2)Fe元素处于d区,Fe和CO形成配合物Fe(CO)5,CO为中性分子,根据化合物化合价的代数和为0,则Fe的化合价为0,
故答案为:d;0;
(3)原子数目和价电子总数均相同的微粒互为等电子体,与CO互为等电子体的分子为N2,离子分别为N2、C22-、CN-,
故答案为:N2、CN-;
(4)在CH4、CH3OH中C原子均成4个σ键,没有孤电子对,故碳原子采取sp3杂化,CO分子结构为C≡O,C原子有一对孤电子对数,所以碳原子采取sp杂化,
故答案为:CH4、CH3OH;
(5)ED4-是ClO4-离子,Cl原子价层电子对数=4+$\frac{1}{2}$(7+1-4×2)=4,没有孤电子对,故其间构型为正四面体型;
C、N、O、Cl四种元素,两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2、CCl4、NCl3等,
故答案为:正四面体;CO2、CCl4、NCl3.
点评 本题是对物质结构的考查,涉及核外电子排布、元素周期表、杂化方式、空间构型、等电子体等,需要学生具备扎实的基础与知识迁移运用能力,难点是空间构型判断,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硝酸可以和大理石反应 | |
| B. | 氢氧化铁沉淀可溶于硝酸 | |
| C. | 分别蘸有浓硝酸和浓氨水的两根玻璃棒靠近时,出现浓烈白烟 | |
| D. | 铜片投入浓硝酸,立刻发生剧烈反应,放出棕红色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2H2(g)+O2(g)=2H2O(g)△H1 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1 C(s)+O2(g)=CO2 (g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
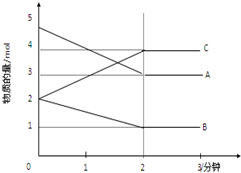 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 非金属性:乙>丁 | |
| C. | 最高价氧化物的水化物的酸性:丙<丁 | |
| D. | 最外层电子数:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S原子结构示意图: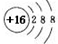 | |
| B. | 二氧化碳的电子式: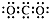 | |
| C. | H、D、T表示同一种核素 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
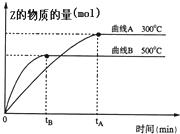 向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.
向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com