
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 |
分析 A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应;
B.碳酸氢钠分解生成水;
C.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性;
D.加入碎瓷片,防止暴沸.
解答 解:A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故A错误;
B.碳酸氢钠分解生成水,则用试管加热碳酸氢钠固体时使试管口略向下倾斜,故B错误;
C.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性,则浓硫酸溅到皮肤上时立即用抹布擦拭,再水冲洗,最后涂上适量的碳酸氢钠溶液,故C错误;
D.制备乙烯时向乙醇和浓硫酸的混合液加入碎瓷片,防止暴沸,从实验安全的角度考虑,故D正确;
故选D.
点评 本题为2015年山东高考题,侧重化学与生活、实验安全的考查,把握物质的性质、实验基本技能、实验安全常识等为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:多选题

| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
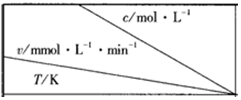 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=6.00 | |
| B. | 同时改变反应温度和蔗糖的浓度,v可能不变 | |
| C. | b<318.2 | |
| D. | 不同温度时,蔗糖浓度减少一半所需的时间相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
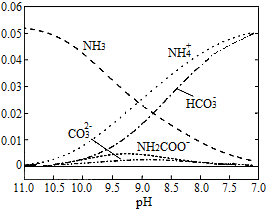
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| D. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
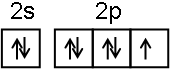 ;NF3中心原子轨道的杂化类型为sp3.
;NF3中心原子轨道的杂化类型为sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入Na2CO3溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入AgNO3溶液中 | D. | SO2通入NaHS溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO的电子式: | |
| B. | 16O的原子结构示意图: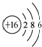 | |
| C. | 质子数为53,中子数为72的碘原子:53125I | |
| D. | 间羟基苯甲醛的结构简式: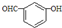 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com