
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | B. | Cu+2AgNO3=2Ag+Cu(NO3)2 | ||
| C. | CaO+H2O=Ca(OH)2 | D. | 3NaOH+FeCl3=3NaCl+Fe(OH)3↓ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
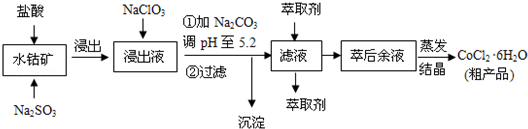
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气 | B. | 丙烯与溴的CCl4溶液 | ||
| C. | 溴乙烷与氢氧化钠 | D. | 乙醇与浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=0.01mol•L-1•min-1 | B. | V(H2)=0.06mol•L-1•min-1 | ||
| C. | V(NH3)=0.02mol•L-1•min-1 | D. | V(H2)=0.002mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
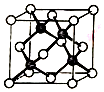 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )| A. | 冰晶胞内水分子间以共价键结合 | |
| B. | 晶体冰与金刚石晶体硬度都很大 | |
| C. | 冰分子间的氢键无方向性和饱和性 | |
| D. | 氢键存在导致冰晶胞与金刚石晶胞排列方式类似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度压强下,NO在某恒容密闭容器中分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示.下列说法正确的是( )
一定温度压强下,NO在某恒容密闭容器中分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示.下列说法正确的是( )| A. | 该反应是一个可逆反应 | B. | 反应后体系内压强增大 | ||
| C. | Y、Z的化学式分别是N2O、N2O3 | D. | Y、Z的化学式分别是N2O、NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
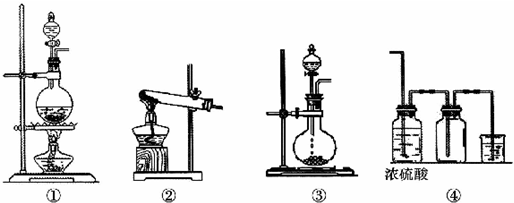
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装材料聚乙烯(PE)因发生加成反应而易老化 | |
| B. | 纤维素与淀粉的组成都能用(C6H10O5).表示,但二者不是同分异构体 | |
| C. | “电木”的主要成分是酚醛树脂,它是由苯酚和甲醛组成的混合物 | |
| D. | 油脂经皂化反应可生成高级脂肪酸盐和甘油,油脂属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com