
分析 (1)依据元素化合价变化分析,元素化合价升高的做还原剂发生氧化反应,元素化合价降低的做氧化剂发生还原反应;
(2)依据②可知得到10mol电子生成1molI2,根据①②电子守恒得到:40mole-转移生成4molI2;
(3)依据氧化还原反应电子守恒结合①②得到配平的氧化还原反应,依据电子守恒标注电子转移;
(4)a、氧化剂的氧化性大于氧化产物分析判断;
b、反应不能判断酸性强弱;
c、还原剂的还原性大于还原产物;
d、反应过程中酸性增强.
解答 解:(1)①H2S+4H2O-8e→SO42-+10H+,反应①中硫元素化合价从-2价变化为+6价,化合价升高失电子做还原剂,故答案为:还原;
(2)根据①②电子守恒得到:40mole-转移生成4molI2,4I2~40e-,;①中失去0.2mol 电子,②中得到0.2mol电子,反应的碘单质物质的量0.02mol,
m(I2)=0.02mol×127g/mol×2=5.08g
故答案为:5.08;
(3)①H2S+4H2O-8e→SO42-+10H+ ②2IO3-+12H++10e→I2+6H2O,依据电子守恒得到5H2S+8KIO3=4K2SO4+4I2+H2SO4+4H2O,
故答案为:5H2S+8KIO3=4K2SO4+4I2+H2SO4+4H2O;
(4)5H2S+8KIO3=4K2SO4+4I2+H2SO4+4H2O,依据反应分析判断;
a、氧化剂KIO3的氧化性大于氧化产物K2SO4、H2SO4,氧化性:K2SO4<KIO3,故a错误;
b、,反应物中无碘酸,反应不能判断酸性强弱;故b错误;
c、还原剂H2S的还原性大于还原产物I2;还原性:H2S>I2,故c正确;
d、反应过程中氢硫酸反应生成硫酸,溶液酸性增强;故d错误;
故答案为:C.
点评 本题考查了氧化还原反应的概念分析,电子转移守恒的计算应用,氧化还原反应中规律的分析判断,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H4 | ||
| C. | 体积相同、密度相等的CO和N2O | D. | 压强相同、体积相同的O2和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的阳离子的氧化性比A的阳离子强,则A元素的金属性不一定比B元素强 | |
| B. | 发生氧化还原反应时,A原子失去的电子比B原子多,证明A的金属性一定比B强 | |
| C. | 适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2═2FeCl3+4FeI3 | |
| D. | A的金属性比B的金属性强,则A一定可以在水溶液置换出B来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃放烟花爆竹 | B. | 为城市主干道洒水保洁 | ||
| C. | 大面积开发土建项目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N-N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N-N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )| A. | N4与N2互为同素异形体 | |
| B. | 1 mol N4气体转化为N2时要放出724 kJ能量 | |
| C. | N4变成N2是化学变化 | |
| D. | N4不可能是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol | B. | 0.8mol | C. | 0.6mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
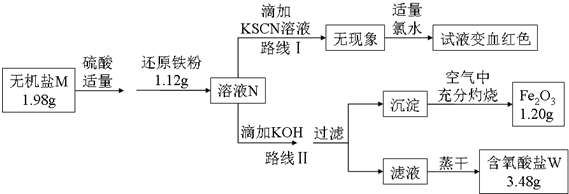
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com