
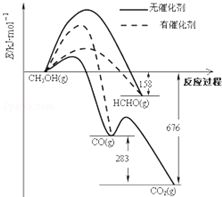
 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)①使用催化剂可以降低反应的活化能,活化能越低,普通分子越容易转化成活化分子,反应越容易,反应速率越快;
②根据图表可知2HCHO(g)+O2(g)═2CO(g)+2H2O(g)中反应物能量高,生成物能量低,故该反应为放热反应,然后依据图中给出数据解答;
(2)根据浓度商与化学平衡常数相对大小确定反应方向,如果浓度商大于平衡常数,则平衡向逆反应方向移动.
解答 解:(1)①根据图象可以看出转化成甲醛时活化能最低,使用催化剂时主要产物为HCHO,故答案为:HCHO;
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)该反应为放热反应,△H=-2(676-158-283)=-470KJ•mol-1,故答案为:-470KJ•mol-1;
(2)浓度商=$\frac{0.8}{0.4×(0.4)^{2}}$=12.5>2.041,则平衡向逆反应方向移动,所以反应速率v正<v逆,故答案为:<.
点评 本题涉及外界条件对化学反应速率的影响、热化学反应等知识点和反应的自发性等知识,根据浓度商与化学平衡常数相对大小确定反应方向,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海带灰的滤液中加入几滴稀硫酸,再加入双氧水,即能使淀粉溶液变蓝2I-+H2O2+2H+═I2+2H2O | |
| B. | Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| C. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| D. | 在AgCl饱和溶液在加入Na2S:2Ag++S2-═Ag2S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件反应:2CO(g)?CO2(g)+C(s)可自发进行,则该反应的△H>0 | |
| B. | 向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明硫酸亚铁溶液已变质 | |
| C. | 升高CH3COONa溶液温度,其水的离子积常数和pH值都增大 | |
| D. | 相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3•H2O,水电离程度由大到小的顺序是:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 标准状况下,22.4L NO 和22.4L O2混合后所得气体中分子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、OH- | B. | Na+、CO32-、OH- | C. | Fe2+、H+、CO32- | D. | Fe3+、K+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:
对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com