
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为__________________。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式____________________________________。
(2)由A、B、W三种元素组成的18电子微粒的分子式为____________________。
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_________________________________________。
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是___________________________________。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
【答案】 第三周期ⅢA族 Al(OH)3 + OH- =AlO2-+ 2H2O CH4O BaO2+H2SO4==BaSO4 ↓+H2O2 2Fe2+ +3 H2O2 + 4I-==2Fe(OH)3↓ + 2I2 56L
【解析】A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有![]() ,
,![]() ,所以B为C元素.
,所以B为C元素.
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为: Al(OH)3 + OH- =AlO2-+ 2H2O ,因此,本题正确答案是:第三周期第ⅢA族; Al(OH)3 + OH- =AlO2-+ 2H2O;
(2)由H、C、O三种元素组成的18电子微粒,该微粒中只能含有1个C原子、1个O原子,故含有H原子数目![]() ,故该微粒结构简式为CH3OH,分子式CH4O
,故该微粒结构简式为CH3OH,分子式CH4O
因此,本题正确答案是: CH4O;
(3)![]() 为
为![]() ,是二元弱酸,硫酸处理
,是二元弱酸,硫酸处理![]() 来制备
来制备![]() ,则还有
,则还有![]() 生成,反应的化学方程式为
生成,反应的化学方程式为![]() ↓
↓![]() ,
,
因此,本题正确答案是:![]() ↓
↓![]() ;
;
(4)向含有![]() 和淀粉KI的酸性溶液中滴入
和淀粉KI的酸性溶液中滴入![]() ,观察到溶液呈蓝色并有红褐色沉淀生成,反应生成
,观察到溶液呈蓝色并有红褐色沉淀生成,反应生成![]() 与
与![]() ,当消耗
,当消耗![]() 时,共转移
时,共转移![]() 电子,说明被氧化的
电子,说明被氧化的![]() 为
为![]() ,参加反应的
,参加反应的![]() 为
为![]() ,该反应的离子方程式是:
,该反应的离子方程式是:![]() ↓
↓![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ↓
↓![]() ;
;
(5) ![]() ↑
↑![]()
![]()
![]() ↑
↑![]()
![]()
![]()
![]() ,
,![]() ,
,
因此,本题正确答案是:56.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】每摩尔物质含有( )。
A. 6.02×1023个分子B. 6.02×1023个原子
C. 阿伏加德罗常数个原子D. 阿伏加德罗常数个该物质的粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体.再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀.根据题意推断气体x的成分可能是( )
A.0.3mol NO2 和0.3mol NO
B.0.2mol NO2和0.1mol N2O4
C.0.1mol NO,0.2mol NO2和0.05mol N2O4
D.0.6mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A. Al2(SO4)3=2A13++3SO42- B. Ba(OH)2=Ba2++(OH-)2
C. Na2SO4=2Na++S04-2 D. Ca(N03)2=Ca2++2(N03) 2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率﹣v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A.![]() (NH3)=0.01 mol/(L?s)
(NH3)=0.01 mol/(L?s)
B.![]() (O2)=0.00l0 mol/(L?s)
(O2)=0.00l0 mol/(L?s)
C.![]() (NO)=0.00l0 mol/(L?s)
(NO)=0.00l0 mol/(L?s)
D.![]() (H2O)=0.045 mol/(L?s)
(H2O)=0.045 mol/(L?s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题. 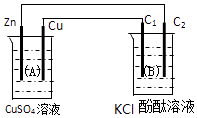
(1)锌极为极,电极反应式为:;
石墨棒C1为极,电极反应式为:;
石墨棒C2附近观察到的实验现象为;
(2)当C2极析出224mL气体(标准状态)时,锌的质量减小g,A池中溶液的质量变化(填增大、不变或减小)g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A.Na+的轨道表示式: ![]()
B.Na+的结构示意图: ![]()
C.Na的电子排布式:1s22s22p63s1
D.Na的简化电子排布式:[Ne]3s1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com