
如下图所示为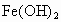 制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.
制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.
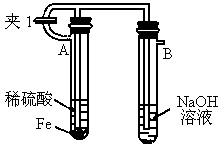
(1)如何操作该装置才能得到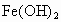 沉淀?
沉淀?
答:___________________.
(2)为何能在较长时间内观察到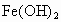 白色沉淀?
白色沉淀?
答:___________________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:物理教研室 题型:058
如下图所示为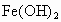 制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.
制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.
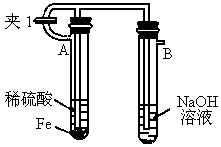
(1)如何操作该装置才能得到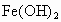 沉淀?
沉淀?
答:___________________.
(2)为何能在较长时间内观察到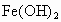 白色沉淀?
白色沉淀?
答:___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
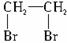
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式:________________________、____________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:________________________。
(3)容器c中NaOH溶液的作用是_______________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时所消耗的乙醇和浓硫酸混合液比正常情况下超过许多。如果装置的气密性没有问题,试解释可能的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。电解法制备高铁酸钾操作简便,成功率高,易于实验室制备。其原理如下图所示。
I. 实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(1)电解过程中,X极是 极,电极反应是 。
(2)电解过程中,Y极放电的有 。
(3)生成高铁酸根(FeO42-)的电极反应是 。
II. 若用不同种电池作为上述实验的电源,请分析电池反应。
(1)铅蓄电池总的化学方程式为:
2H2O+2PbSO4 Pb+PbO2+2H2SO4,则它在充电时的阳极反应为
。
(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH--2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为 。
(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料。已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气和液态水,放出624kJ的热量,则N2H4完全燃烧的热化学方程式是 ;
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是 。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O。
写出该电池正极的电极反应: 。
(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2010年上海市青浦高中5月高二化学试题 题型:实验题
已知乙醇可以和无水CaCl2反应生成微溶于水的CaCl2?6C2H5OH 。
有关试剂的沸点如下:CH3COOC2H5 77.1℃; C2H5OC2H5 34.5℃;
C2H5OH 78.3℃; CH3COOH 118℃。
某课外小组用如下图所示装置制备乙酸乙酯粗产品,试回答下列问题:
(1)蒸馏烧瓶中加入的试剂是:冰乙酸、酒精和浓硫酸,
其中浓H2SO4的作用是 和 。
(2)冷凝管中最先冷凝的馏分是 , 弃去低沸点的馏分。收集沸点在76℃~120℃
之间的馏分,将其倾倒入饱和Na2CO3溶液中观察到的现象是: 。
上述实验中饱和碳酸钠溶液的作用是_____(填序号)
A.中和乙酸和乙醇; B.中和乙酸并溶解乙醇;
C.加速酯的生成,提高酯的产率 D.有利于分层析出。
(3)写出上述实验中用CH3COOH、CH3CH218OH和浓硫酸制备乙酸乙酯的化学方程式:
。
(4)分离出粗产品乙酸乙酯,再加入无水CaCl2,震荡分离的目的是:
为了干燥乙酸乙酯可选用的最佳干燥剂为 ________ (填序号)
A.五氧化二磷 B.无水硫酸钠 C.碱石灰 D.固体氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com