
| A、明矾 |
| B、二氧化氯 |
| C、臭氧 |
| D、高铁酸钠( Na2FeO4) |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、对垃圾进行无害化、资源化处理 |
| B、将煤气化或液化,获得清洁燃料 |
| C、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 |
| D、推广使用无磷洗衣粉和无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
| C | 在容积可变的密闭容器中发生反应:2NH3(g)?N2H4(l)+H2(g),把容积的体积缩小一半 | 正反应速率加快,逆反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
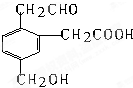 某有机物的结构式如图它在一定条件下可能发生的反应有①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥加聚( )
某有机物的结构式如图它在一定条件下可能发生的反应有①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥加聚( )| A、②③④ | B、①③⑤⑥ |
| C、①③④⑤ | D、②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ①图象中曲线
①图象中曲线| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:

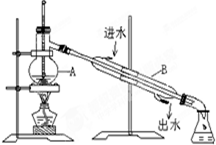 图中装置中仪器的名称:
图中装置中仪器的名称:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热化学方程式中化学计量数表示分子个数 |
| B、该反应的△H2=+483.6 kJ/mol |
| C、形成2mol H-O键放出能量比断2mol H-H及1mol O=O键所需能量多483.6kJ |
| D、|△H2|>|△H1| |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com