
【题目】在0.01mol/L醋酸中存在下列平衡:CH3COOH![]() H++CH3COO-,若要使溶液的pH和c( CH3 COO-)均减小,可采取的措施是
H++CH3COO-,若要使溶液的pH和c( CH3 COO-)均减小,可采取的措施是
A.适当升高温度B.加入稀盐酸C.加入 CH3COONa固体D.加入少量水
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(1)毒重石用盐酸浸取前需充分研磨,目的是________。
(2)实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________________。
A.烧杯 B.容量瓶 C.玻璃棒 D.滴定管
(3)加入NH3·H2O调pH=8可除去________________(填离子符号),滤渣Ⅱ中含________________(填化学式)。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+![]() Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
①BaCl2溶液的浓度为________________mol·L-1。
②若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将____________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1mLpH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是

A. 加热HA溶液时,溶液酸性增强
B. lmol/LHA溶液与1mol/LNaOH溶液等体积混合,若所得溶液中c(Na+)>c(A-),则2<a<4
C. 某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=1014-d
D. HA溶液与NaOH溶液恰好完全反应时,一定有c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)![]() 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)![]() SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________。
(2)关于CO还原SO2的反应,下列说法正确的是______。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。
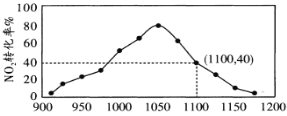
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为____________
(2)已知HN3是一种弱酸,其在水溶液中的电离方程式为HN3![]() H++N3-,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为___________。
H++N3-,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为___________。
(3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+ 的配位数是___________,1mol该配离子中所含σ键的数目为____,配位体NH3的空间构型为:___________ 。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________。
(5)NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如下图),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁是黄色晶体,常用作照相显影剂、新型电池材料等。
实验室制备草酸亚铁并测定其中Fe2+和C2O42的物质的量之比确定其纯度,步骤如下:
Ⅰ.称取一定质量的硫酸亚铁铵[(NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取m gⅠ中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热,用c mol·L1 KMnO4溶液滴定至终点,消耗KMnO4溶液v1 mL(其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用c mol·L1 KMnO4溶液滴定滤液至终点,消耗KMnO4溶液v2 mL。
Ⅳ.重复上述实验3次,计算。
已知:ⅰ.草酸是弱酸。
ⅱ.pH>4时,Fe2+易被O2氧化。
ⅲ.酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
(1)Ⅰ中加入稀硫酸的目的是______、______。
(2)Ⅱ中与KMnO4溶液反应的微粒是______、______。
(3)Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V ______v2 mL(填“>”、“=”或“<”)。
(4)Ⅲ中,滴定时反应的离子方程式是______。
(5)m gⅠ中制得的晶体中,Fe2+和C2O42的物质的量之比是______(用含v1、 v2的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是______,属于金属材料的是______(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是______。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为______,反应基本类型是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com