

| PdCl2 |


| HBr |
| NaOH��Һ |
| �� |
 ����CH3��2CH2CH2COOH�ֵ�һ�֣�A����ʽΪC7H8O������FeCl3��Һ������ɫ��Ӧ����˵��A�к��з��ǻ��ͼ�������G�Ľṹ��ʽ���Կ���AΪ
����CH3��2CH2CH2COOH�ֵ�һ�֣�A����ʽΪC7H8O������FeCl3��Һ������ɫ��Ӧ����˵��A�к��з��ǻ��ͼ�������G�Ľṹ��ʽ���Կ���AΪ ��A���ϩ�����ӳɷ�Ӧ����BΪ
��A���ϩ�����ӳɷ�Ӧ����BΪ ��B�����������ӳɷ�Ӧ����CΪ
��B�����������ӳɷ�Ӧ����CΪ ����EΪ��CH3��2CH2CH2COOH��DΪ��CH3��2CH=CH2������л���Ľṹ�������Լ���ĿҪ������⣮
����EΪ��CH3��2CH2CH2COOH��DΪ��CH3��2CH=CH2������л���Ľṹ�������Լ���ĿҪ������⣮ ����CH3��2CH2CH2COOH�ֵ�һ�֣�A����ʽΪC7H8O������FeCl3��Һ������ɫ��Ӧ����˵��A�к��з��ǻ��ͼ�������G�Ľṹ��ʽ���Կ���AΪ
����CH3��2CH2CH2COOH�ֵ�һ�֣�A����ʽΪC7H8O������FeCl3��Һ������ɫ��Ӧ����˵��A�к��з��ǻ��ͼ�������G�Ľṹ��ʽ���Կ���AΪ ��A���ϩ�����ӳɷ�Ӧ����BΪ
��A���ϩ�����ӳɷ�Ӧ����BΪ ��B�����������ӳɷ�Ӧ����CΪ
��B�����������ӳɷ�Ӧ����CΪ ����EΪ��CH3��2CH2CH2COOH��DΪ��CH3��2CH=CH2��
����EΪ��CH3��2CH2CH2COOH��DΪ��CH3��2CH=CH2�� ������Ϊ3-�����ӣ��������ӣ���
������Ϊ3-�����ӣ��������ӣ��� ��B��C�Ļ�ѧ����ʽΪ
��B��C�Ļ�ѧ����ʽΪ +3H2
+3H2| ���� |
 ��
�� +3H2
+3H2| ���� |
 ��
�� ����Ӧ��ͬ���칹�壬������к���4�ֻ�ѧ��������ԭ�ӣ����Ӧ�ĸ�����Ϊ9��2��2��1�����ܵĽṹΪ
����Ӧ��ͬ���칹�壬������к���4�ֻ�ѧ��������ԭ�ӣ����Ӧ�ĸ�����Ϊ9��2��2��1�����ܵĽṹΪ ��
�� ��
�� ��
�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ܢۢڢ� | B���٢ܢۢ� |
| C���ڢۢܢ� | D���٢ܢڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��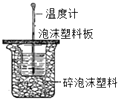 �ⶨ��Ӧ�к��� |
B�� �ⶨ��Ӧ���� |
C�� ʵ�ֻ�ѧ��ת��Ϊ���� |
D�� �ⶨʳ��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������������ϵ��Ƿ��ͻ����H+���������������ȣ�� |
| B��������ƽ���֪��С������ʱҪ�ٳ��Ƕಹ�� |
| C������СOH-��Ũ�ȣ�����ƽ�⽫�����ƶ���Ksp��ֵ��Ӧ���� |
| D��ʹ�ú��������ܷ�ֹȣ�ݣ�����ΪCa5��PO4��3OH��s��ת��Ϊ�����ܵ�Ca5��PO4��3F��s��[Ca5��PO4��3F��s����Ksp=2.8��10-61] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��10mL 0.5mol/L��������Һ��10mL0.5mol/LBa��OH��2��Һ��Ϸ�Ӧ��3Ba2++6OH-+2Al3++3SO42-=3BaSO4��+2Al��OH��3�� | ||||
| B������ͭ��Һ�����ԣ�Cu2++2H2O�TCu��OH��2��+2H+ | ||||
C����̼�������Һ�мӹ���ʯ��ˮ�����ȣ�NH4++OH-
| ||||
| D�����ữ�ĸ��������Һ����˫��ˮ��2MnO4-+6H++5H2O2=2Mn2++5O2��+8H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��AgCl��Һ�У�c��Cl-����c��Ag+����һ����ֵ |
| B��AgCl������ˮ����Һ��û��Ag+��Cl- |
| C�������¶ȣ�AgCl�������ܽ������ |
| D����AgCl�����м���NaCl���壬�������ܽ�Ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ǿ����HCN��HClO |
| B��pH��HClO��HCN |
| C����NaOHǡ����ȫ��Ӧʱ������NaOH�����ʵ�����HClO��HCN |
| D���������Ũ�ȣ�c��CN-����c��ClO-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Fe3+ |
| B��Mg2+ |
| C��Fe2+ |
| D��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| Ũ��/mol��L | 4x10��6 | 6x 10��6 | 2x10��5 | 4x10��5 | 3x10��5 | 2x10��5 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com