
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届浙江省富阳市高三上学期第二次质检化学试卷(解析版) 题型:填空题
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得。实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75∶2);②在碳存在下,X与N2反应生成AlN。请回答:
(1)X的化学式为 。
(2)碳热还原制备氮化铝的总反应化学方程式为:
Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g)
2AlN(s)+3CO(g)
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如下图曲线甲所示。下列说法不正确的是 。
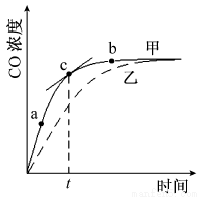
A.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
B.c点切线的斜率表示该化学反应在t时刻的瞬时速率
C.在不同时刻都存在关系:v(N2)=3v(CO)
D.维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
②一定温度下,在压强为p的反应体系中,平衡时N2的转化率为α,CO的物质的量
浓度为c;若温度不变,反应体系的压强减小为0.5p,则N2的平衡转化率将 α (填“<”、“=”或“>”),平衡时CO的物质的量浓度
A.小于0.5c B.大于0.5c,小于c
C.等于c D.大于c
③该反应只有在高温下才能自发进行,则随着温度升高,反应物Al2O3的平衡转化率将 (填“增大”、 “不变”或“减小”),理由是 。
(3)在氮化铝中加入氢氧化钠溶液,加热,吸收产生的氨气,进一步通过酸碱滴定法可以测定氮化铝产品中氮的含量。写出上述过程中氮化铝与氢氧化钠溶液反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:填空题
按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________________.
(2)25℃、101 kPa条件下充分燃烧1kg丁烷生成二氧化碳和液态水时,放出热量为5×104 kJ,写出表示丁烷燃烧热化学方程式________________
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)═CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+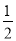 O2(g)═H2O(l) ΔH3=-285.8 kJ/mol
O2(g)═H2O(l) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式__________________
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=Q1kJ·mol-1
2CO2(g)+H2 (g)=C2H2(g)+2O2(g) △H2=Q2kJ·mol-1。
写出由C(s,石墨)和H2(g)生成C2H2(g)的热化学方程式:________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
在温度体积不变的条件下发生反应:NO2(g)+SO2(g)  SO3(g)+NO(g)将NO2与SO2以体积比3:1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)将NO2与SO2以体积比3:1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.混合气体密度保持不变
B.体系压强保持不变
C.SO2和NO的体积比保持不变
D.每消耗1mol SO2的同时生成1molNO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列有关 、
、 、
、 说法错误的是
说法错误的是
A.是碳元素的三种同位素
B.是不同的原子
C.化学性质完全不同
D.其中的 14C和14N所含的质量数相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高二上学期期中测试化学试卷(解析版) 题型:选择题
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
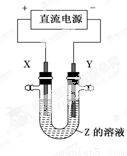
A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
查看答案和解析>>
科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:选择题
分子式为C5H8O2 的有机物,能使溴的CCl4 溶液褪色,也能与NaHCO3 溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)最多有
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。
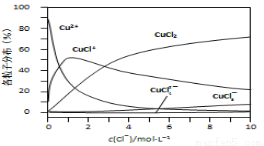
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
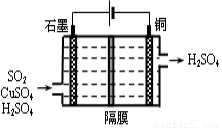
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用上图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com