
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 水中溶解性 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
| A、萃取法 | B、升华法 |
| C、蒸馏法 | D、分液法 |
科目:高中化学 来源: 题型:
| A、滴定管装滴定液时应先用滴定液润洗 |
| B、锥形瓶用作反应容器时一定不能加热 |
| C、蒸馏时温度计水银球可以高于蒸馏瓶支管口 |
| D、振摇分液漏斗时只需要塞上其玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
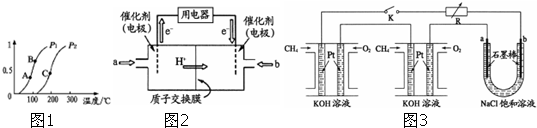
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离程度始终增大 | ||
B、
| ||
| C、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||
| D、当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
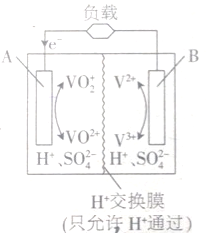 (1)B电极为电池的
(1)B电极为电池的查看答案和解析>>
科目:高中化学 来源: 题型:
| A、目前使用的元素周期表中,最长的周期含有36种元素 |
| B、周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
| C、非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
| D、IA族与VIIA族元素间可形成共价化合物或离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16 g O2含有NA个氧原子 |
| B、1mol苯含有3NA个碳碳单键和3NA个碳碳双键 |
| C、一定条件下,3molH2和1molN2充分反应后,可得到2NA个NH3分子数 |
| D、1 mol?L-1FeCl3溶液中含有Cl-总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
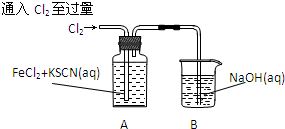 | 现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
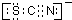 ,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;
,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取 5.2mL 盐酸 |
| B、用100mL量筒量取 5.2mL 盐酸 |
| C、用托盘天平称取25.02g NaCl |
| D、用100 mL 容量瓶配制 50 mL 0.1 mol/L 的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com