
分析 电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
单质和混合物,既不是电解质也不是非电解质.
解答 解:A.NaCl水溶液中或熔融状态下能导电属于电解质;
B.CaCO3 属于盐熔融状态导电属于电解质;
C.NH3本身不能电离出离子的化合物属于非电解质;
D.Cu是金属单质既不是电解质也不是非电解质;
E.盐酸是氯化氢的水溶液,是电解质溶液,既不是电解质也不是非电解质;
F.H2O能微弱的电离出离子属于电解质;
G.CH3OH自身不能放松电离属于非电解质;
H.Ba(OH)2 是强碱,水溶液中电离属于电解质;
I.NH3•H2O在水溶液中电离属于电解质;
J.CO2 自身不能电离的化合物属于非电解质;
故答案为:A、B、H、F、I;C、G、J;D、E.
点评 本题考查了电解质、非电解质、强电解质、弱电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.


科目:高中化学 来源: 题型:解答题
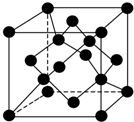 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
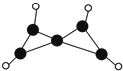 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )| A. | X在常温下不能稳定存在 | |
| B. | X的性质与烯烃类似,容易发生加成反应 | |
| C. | X不能使酸性KMnO4溶液褪色 | |
| D. | 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
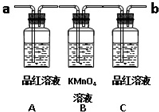 已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.
已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
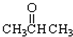 ③CH3CH2Br ④
③CH3CH2Br ④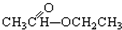 ⑤
⑤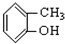 ⑥
⑥ ⑦
⑦ ⑧
⑧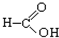 ⑨
⑨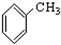 ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、M的离子半径及最高价氧化物对应水化物的碱性皆为M<W | |
| B. | YZ2为直线型的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Y与X形成的化合物的熔沸点一定低于Z与X形成的化合物的熔沸点 | |
| D. | Z与M形成的化合物可作为耐高温材料,W、M、X以1:1:4组成的化合物是应用前景很广泛的储氢材料,具有很强的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
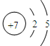 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
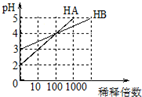
| A. | 向等体积等浓度的HA和HB溶液中滴加等浓度的NaOH溶液,至至溶液呈中性,HB消耗的NaOH多 | |
| B. | 加水稀释HB酸溶液,则c(H+)/c(HB)减小 | |
| C. | 常温下,用pH=a的V1L HA酸与pH=b的V2L NaOH溶液混合,若a+b=14,则反应后溶液呈中性 | |
| D. | 若向等体积等pH的HB和HA酸溶液加入足量锌粉,均反应生成H2,最终HB生成的H2多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com