
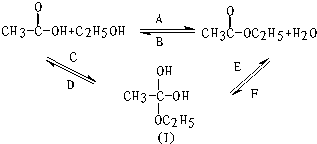
 如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.
如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.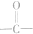 )或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.
)或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水. 分析 (1)题中涉及反应有酯化反应以及酯的水解,二者都为取代反应,还涉及到羧基的加成以及羟基的消去;
(2)羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,即酸去羟基醇去羟基氢.
解答 解:(1)从图示可知A反应烷氧基取代了羟基,属于取代反应,
B反应为水中羟基取代了烷氧基,属于取代反应;
C反应双键变成了单键属于加成反应,
D反应形成了双键属于消去反应,
E反应形成了双键属于消去反应,
F反应双键变成了单键属于加成反应,
故答案为:AB;CF;
(2)羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,将原料C2H50H中的氧原子用18O标记,则生成物乙酸乙酯中有18O,
如果将原料CH3COOH中羰基(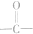 )的氧原子用18O标记,则生成物乙酸乙酯中有18O,而水中没有18O;
)的氧原子用18O标记,则生成物乙酸乙酯中有18O,而水中没有18O;
如果将原料CH3COOH中羟基的氧原子用18O标记,C-O键断裂,则水中有18O,
故答案为:有;前者没有、后者有;羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.
点评 考查酯化反应的原理与特点,为高频考点,注意羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,难度不大.


科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌 | |
| C. | 不慎将浓硝酸沾到皮肤上,立即用NaOH溶液冲洗 | |
| D. | 检测某溶液是否含有SO${\;}_{4}^{2-}$时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
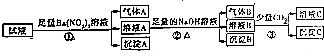
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂. ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| B. | 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀 | |
| C. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| D. | 二氧化硫漂白过的草帽过一段时间后变黄 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com