
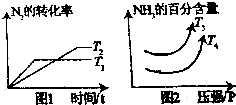
 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程分析 ①据图1可知温度高速度快,T1先达平衡,则T1>T2,从T1到T2是降温,氮气的转化率升高,说明平衡正向移动,则正方向是放热反应;在相同压强下,从T4到T3氨气的百分含量升高,说明平衡正向移动,对于放热反应,降温向放热方向移动,则T4>T3;
②设平衡时转化的氮气的物质的量为xmol,列三行式求解;恒温恒容,压强之比等于物质的量之比;K=$\frac{生成物平衡时浓度幂之积}{反应物平衡时浓度幂之积}$;对于放热反应,升温,K值减小.
解答 解:①据图1可知温度高速度快,T1先达平衡,则T1>T2,从T1到T2是降温,氮气的转化率升高,说明平衡正向移动,则正方向是放热反应,△H1<0;在相同压强下,从T4到T3氨气的百分含量升高,说明平衡正向移动,对于放热反应,降温向放热方向移动,则T4>T3,
故答案为:<;<;
②设平衡时,转化的氮气的物质的量为xmol,列三行式求解:
N2(g)+3H2(g)?2NH3(g)
起始的物质的量(mol):2 6 0
转化的物质的量(mol):x 3x 2x
平衡时物质的量(mol):2-x 6-3x 2x
NH3的体积分数为60%,即物质的量分数为60%,$\frac{2x}{2-x+6-3x+2x}$=60%,解得x=1.5,
则0到10min内用H2表示化学反应速率为v(H2)=$\frac{△c({H}_{2})}{△t}$=$\frac{3×1.5mol}{2L×10min}$=0.225mol/(L•min),
N2的转化率=$\frac{氮气的转化量}{氮气的起始量}$=$\frac{1.5mol}{2mol}$×100%=75%,
恒温恒容,反应开始和平衡状态体系的压强之比等于反应开始和平衡状态物质的量之比,即$\frac{{P}_{0}}{{P}_{平}}$=$\frac{2mol+6mol}{(2-1.5+6-3×1.5+2×1.5)mol}$=$\frac{8}{5}$,
K=$\frac{生成物平衡时浓度幂之积}{反应物平衡时浓度幂之积}$=$\frac{(\frac{3}{2})^{2}}{\frac{0.5}{2}×(\frac{1.5}{2})^{3}}$=21.33,
对于放热反应,升温,K值减小,
故答案为:0.225mol/(L•min);75%;8:5;21.33;减小.
点评 本题重点考查化学平衡图象的分析,注意拐点代表平衡,先拐先平衡,先拐温度高,在比较温度时要统一压强;化学平衡的计算,三行式是解题的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| B. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| C. | 明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同 | |
| D. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片浸入氯化铁溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 一小块钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 稀盐酸滴入硝酸银溶液中:Ag++Cl-═AgCl↓ | |
| D. | 烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、CO${\;}_{3}^{2-}$ | B. | Na+、I-、Cl-、OH- | ||
| C. | NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、K+、OH- | D. | Na+、Al3+、SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | R分子有3种含氧官能团 | B. | 1molR最多消耗5mol NaOH | ||
| C. | R与氯化铁溶液发生显色反应 | D. | R能发生取代、加成、氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过量的氢气与氮气 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
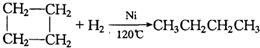
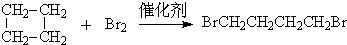 、
、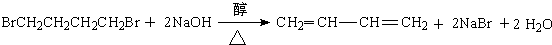 .
.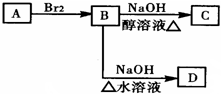
 ;C
;C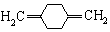 .
.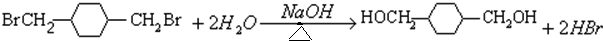 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com