
【题目】常温下,回答下列关于酸和碱中和反应的问题:
将某一元酸HA 和NaOH溶液等体积混合,分别进行编号①、②、③的实验,实验数据记录事表
序号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>9 |
请回答:
(1)根据①组实验情况,混合溶液pH=9的原因是_____________(用离子方程式表示)。
(2)混合溶液①中由水电离出的c (H+)_____0.1moI/LNaOH溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(3)根据①组实验情况,在该溶液中下列关系式正确的是(填序号字母)______。
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)②组情况表明,c_________0.2mol/L (选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)____c(Na+) (选填“>”、“<”或“=”)。
(5)从③组实验结果分析,离子浓度由大到小的顺序是_________________________。
【答案】 A-+H2O![]() HA+OH- > ABC > = c (Na+) >c (A-) >c (OH-) >c (H+)
HA+OH- > ABC > = c (Na+) >c (A-) >c (OH-) >c (H+)
【解析】本题主要考查有关中和反应及盐类水解的判断和计算。
(1)根据①组实验情况,中和反应恰好完全进行,形成NaA溶液,混合溶液pH=9的原因是NaA水解使溶液呈碱性,A-+H2O![]() HA+OH-。
HA+OH-。
(2)盐类水解促进水的电离,酸、碱抑制水的电离,所以混合溶液①中由水电离出的c(H+)>0.1moI/LNaOH溶液中由水电离出的c(H+)。
(3)根据①组实验情况,形成NaA的溶液,NaA水解使溶液呈碱性。A.电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),故A正确;B.元素守恒:c(Na+)=c(HA)+c(A-),故B正确;
C.质子守恒:c(HA)+c(H+)=c(OH-),故C正确;D.电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),c(HA)≠0,所以c(Na+)+c(H+)≠c(OH-)+c(A-)+c(HA),故D错误。故选ABC。
(4) 若c=0.2mol/L,中和反应恰好完全进行,形成NaA溶液,NaA水解使溶液呈碱性。②组情况表明pH=7,所以c>0.2mol/L。混合溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),而且c(H+)=c(OH-),所以c(A-)=c(Na+)。
(5)从③组实验结果分析,形成等浓度的HA、NaA的混合溶液,pH>9表明NaA的水解程度大于HA的电离程度,所以离子浓度由大到小的顺序是c (Na+) >c (A-) >c (OH-) >c (H+)。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为:
Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
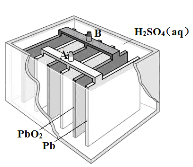
下列说法不正确的是
A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l)
B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接
C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接
D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择适当的实验操作分离下列混合物: ①分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物 .
②从溴水中的提取溴单质;
③分离汽油和水 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/[c(CH3COOH).c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中[c(NH4+)/c(Cl-)]>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2在食品、医药、电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可做净水剂,其理由是____________________(用离子方程式表示)。
(2)相同条件下,0.1mol/LNH4Al(SO4)2溶液中,c(NH4+)_____0.1mol/LNH4HSO4溶液中c(NH4+)(填“大于”、“等于”或“小于”)。
(3)下图是0.1mol/L 电解质溶液的pH 随温度变化的图像。

①其中符合0.1mol/LNH4Al(SO4)2溶液的是________(填字母)。导致溶液pH随温度变化的原因是_____________________________。
②20℃时,0.1mol/LNH4Al(SO4)2溶液中,2c(SO42-)-c(NH4+) -3c(Al3+)=_____mol/L。
(4)室温时,向0.1mol/LNH4Al(SO4)2溶液中滴加0.1mol/LNaOH 溶液。得到溶液pH与NaOH溶液体积关系曲线如图所示:
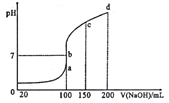
①已知:Ksp[Al(OH)3]=1×10-33,Al3+沉淀完全时(使其浓度小于1×10-6mol·L-1),溶液的pH=_______,试分析图中a、b、c、d四点,水的电离程度最大的是______________________。
②在b点,溶液中各离子浓度由大到小的顺序是_______________。
③b-c段随着NaOH的加入,溶液中c(NH3·H2O)/c(OH-)的值_____(填“增大”、“减小”或 “不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研究出制取ClO2的新方法,其反应的微观过程如下所示:

下列有关该反应的叙述中正确的是( )
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3C12+6KOH![]() KClO3+5KC1+3H2O的反应中,下列说法中正确的是
KClO3+5KC1+3H2O的反应中,下列说法中正确的是
A. KCl是氧化产物,KClO3是还原产物 B. 每消耗22.4LCl2,转移2mol电子
C. KOH和H2O均为强电解质 D. Cl2在反应中既作氧化剂又作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
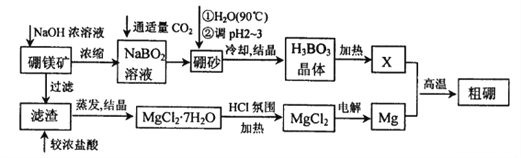
(1)硼砂中B的化合价为_________;滤渣的主要成分为_______________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_________________________。
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为______________________________。
(4)MgCl2·6H2O需要在HCl氛围中加热,其目的是______________________。
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com