
| A. | 向Na2CO3溶液中通入CO2至溶液为中性,则$\frac{c(N{a}^{+})}{2c(C{O}_{3}^{2-})}$>1 | |
| B. | pH相同的氨水和Ba (OH)2溶液中:2c (NH4+)=c ( Ba2+) | |
| C. | 等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH-)-c(H+)=c(HSO3-)+c(H2SO3) | |
| D. | 向Mg (OH)2浊液中加入少量NH4Cl粉末$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$不变 |
分析 A.混合溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒,根据电荷守恒得c (Na+)=2c ( CO32-)+c(HCO3-);
B.pH相同的氨水和Ba (OH)2溶液中c(OH-)、c(H+)分别相等,根据电荷守恒判断;
C.等浓度的KHSO3溶液与KOH溶液等体积混合,二者恰好完全反应生成亚硫酸钾,溶液中存在质子守恒,根据质子守恒判断;
D.氯化铵水解导致溶液酸性,氢氧化镁和氢离子反应生成镁离子和水.
解答 解:A.混合溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒,根据电荷守恒得c (Na+)=2c ( CO32-)+c(HCO3-),所以$\frac{c(N{a}^{+})}{2c(C{O}_{3}^{2-})}$>1,故A正确
B.pH相同的氨水和Ba (OH)2溶液中c(OH-)、c(H+)分别相等,根据电荷守恒得c (NH4+)=2c ( Ba2+),故B错误;
C.等浓度的KHSO3溶液与KOH溶液等体积混合,二者恰好完全反应生成亚硫酸钾,溶液中存在质子守恒,根据质子守恒得c(OH-)-c(H+)=c(HSO3-)+2c(H2SO3),故C错误;
D.氯化铵水解导致溶液酸性,氢氧化镁和氢离子反应生成镁离子和水,所以镁离子浓度增大、氢氧根离子浓度减小,所以$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$增大,故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确溶液中溶质成分及其性质、溶液酸碱性是解本题关键,注意电荷守恒、物料守恒及质子守恒的灵活运用,易错选项是D.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:填空题
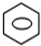 +HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$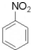 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe→FeCl3 | B. | SiO2→Na2SiO3 | C. | Al2O3→Al(OH)3 | D. | NaO→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锡铁制品镀层破损后铁不易被腐蚀 | |
| B. | 相同温度下,pH相同的盐酸和硫酸中水的电离程度相同 | |
| C. | 向饱和石灰水中滴加少量CuC12溶液出现蓝色沉淀,则Ksp[Ca(OH)2]<Ksp[Cu(OH)2] | |
| D. | 合成氨生产中,需将NH3液化分离,目的是加快正反应速率,并提高H2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原素Z、W的简单离子的电子层结构不同 | |
| B. | Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
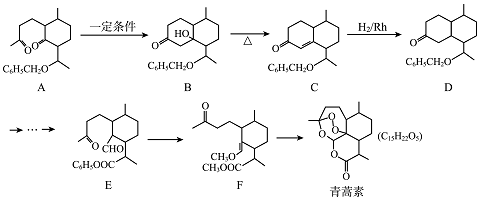
 ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.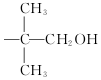 基团;
基团;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2→CO2+2H2O | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com