
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,32 g氧气所含的原子数为NA
B.标准状况下,22.4 L 四氯化碳的分子数为NA
C.0℃,101 kPa下,44.8 L氮气所含有的分子数为2NA
D.常温常压下,1 mol氦气含有的分子数为2NA
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】氢溴酸常用于合成镇静剂和麻醉剂等医药用品。已知: 液溴是易挥发的深红棕色液体,沸点为58.78℃。质量分数为47%的氢溴酸是易挥发的无色液体,沸点 为 126℃. 实验室制备质量分数为47%的氢溴酸的一种方法如下。回答下列问题:
实验橾作 | 现象 |
I .向锥形瓶中依次加入适量冰水、m1g 液溴,再通入SO2充分反应 | 得到淡黄色溶液 |
II. 将操作 I 所得溶液转移至蒸馏烧瓶,蒸馏 | 锥形瓶中得橙黄色粗产品 |
III.在不断搅拌下,向锥形瓶中加入适量Na2SO3溶液 | (1)①_____ |
IV.继续加入适量 Ba(OH)2 溶液 | ②______ |
V.过滤,滤液经蒸馏后得质量分数为47%的氢溴酸m2g |
(2)操作 II的蒸馏装置如图所示(部分夹持装置省略),仪器a的名称是_________ ,装置中除缺石棉网外还有两处明显错误,分别是_________、 _______________。
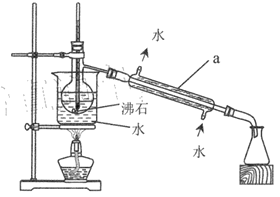
(3)操作III加入适量Na2SO3 发生反应的离子方程式为 __________。
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂 __________检验。若观察到的现象为________,则推测正确。
(5)质量分数为 47%的氢溴酸的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取乙烯,并用来验证乙烯化学性质的实验装置,其中B中盛放的是溴水,C中盛放的是酸性KMnO4溶液。
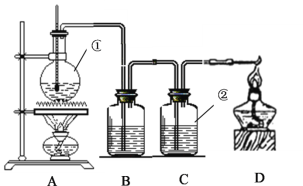
(1)写出①中发生反应的化学方程式____________________________________,
(2)B瓶中的现象是__________________,C瓶中的现象是__________________,这两种现象可以证明乙烯是_____________。(填“饱和烃”或“不饱和烃”)
(3)写出B瓶中发生反应的方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+核外电子排布式为___。
(2)ClO4-空间构型是___;与ClO4-互为等电子体的一种分子为___(填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为___;C、N、O三种元素的电负性由大到小的顺序为___。
(4)高氯酸三碳酰肼合镍可由NiO、髙氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为___。
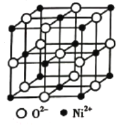
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。
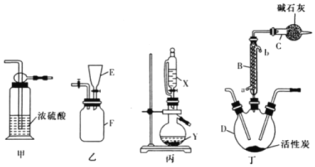
(1)化合物SO2Cl2中S元素的化合价为__。
(2)仪器D的名称是___。
(3)乙、丙装置制取原料气Cl2与SO2。
①乙装置F中充满Cl2,则E中所盛放的溶液为___(填溶液的名称)。
②丙装置中试剂X、Y的组合最好是__。
A.98%浓硫酸+Cu B.70%H2SO4+Na2SO3 C.浓HNO3+Na2SO3
(4)上述装置的正确连接顺序为__、__、丁、__、__(用甲、乙、丙表示,可重复使用)__。
(5)B装置中从a口通入冷水的作用是__;C装置的作用是__。
(6)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为__。
(7)若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为__(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
一定条件下,在2L密闭容器内,反应2NO2![]() N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均反应速率___。在第5s时,NO2的转化率为___。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科学家团队通过镁热还原法将天然的硅藻土转化为具有多级孔道结构的硅框架,并将该硅框架与熔融态的锂金属混合制成具有多孔结构的复合锂金属。一种全固态锂金属电池是以复合锂金属为a极,磷酸铁锂为b极,聚环氧乙烷基聚合物(PEO-SPE)为固态电解质(如图所示),该电池的总反应为:LiFePO4![]() xLi+Li1-xFePO4。下列说法不正确
xLi+Li1-xFePO4。下列说法不正确
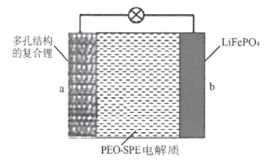
A.放电时Li+通过固态电解质向b极移动
B.多孔结构的复合锂金属有利于锂金属的均匀沉积和脱出
C.充电时,b极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4
D.充电时,当a极质量增加mg时,理论上b极质量减少mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com