
| A. | 环己醇分子中所有的原子可能共平面 | |
| B. | 按系统命名法,(CH3CH2)2CHCH3化合物的名称是3-乙基丁烷 | |
| C. | 芳香化合物A(C8H8O3)分子中含有酯基和醚键两种含氧官能团,A可能的同分异构体有4种 | |
| D. | 在一定条件下,1.0 mol的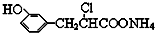 最多能与含4.0 mol NaOH的溶液完全反应 最多能与含4.0 mol NaOH的溶液完全反应 |
分析 A.环己醇中C原子具有甲烷结构特点;
B.该物质主链上有5个C原子;
C.芳香化合物A(C8H8O3)分子中含有酯基和醚键两种含氧官能团,支链上含有2个C原子,支链可能是CH3O-和HCOO-,或HCOOCH2O-;
D.该物质中酚羟基、氯原子水解生成的HCl、羧酸氨都能和NaOH反应.
解答 解:A.环己醇中C原子具有甲烷结构特点,甲烷分子中所有原子不共面,则该物质中所有原子不共平面,故A错误;
B.该物质主链上有5个C原子,其名称是3-甲基戊烷,故B错误;
C.芳香化合物A(C8H8O3)分子中含有酯基和醚键两种含氧官能团,支链上含有2个C原子,支链可能是CH3O-和HCOO-,有邻间对三种结构,如果含有HCOOCH2O-,有一种,所有符合条件的同分异构体有4种,故C正确;
D.该物质中酚羟基、氯原子水解生成的HCl、羧酸氨都能和NaOH反应,则在一定条件下,1.0 mol的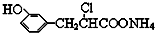 最多能与含3.0 mol NaOH的溶液完全反应,故D错误;
最多能与含3.0 mol NaOH的溶液完全反应,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及计算能力,明确物质侧重的官能团、有机物命名、原子共面等知识点是解本题关键,注意知识迁移的方法和运用,易错选项是D.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:解答题
 .
.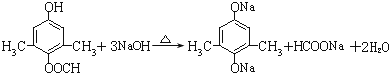
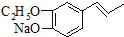
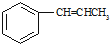 为原料制备
为原料制备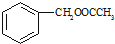 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: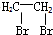
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
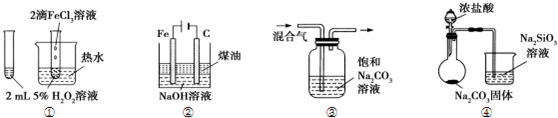
| A. | ①验证FeCl3对H2O2分解反应有催化作用 | |
| B. | ②制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | ③除去CO2气体中混有的SO2 | |
| D. | ④比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
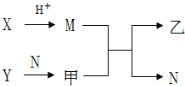 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | 相对分子质量M>N,沸点N>M | |
| B. | A、C、D的常见氧化物相互之间一定能反应 | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:| 粒子代码 | A | B | C | D |
| 原子核数目 | 单核 | 不同元素构成的两核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子所带电荷数 | 0 | 0 | 0 | 两个负电荷 |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,0.5 molNO与0.5 molO2混合后气体分子数为0.75 NA | |
| B. | 某温度下纯水的pH=6,该温度下10 L pH=11的NaOH溶液中含OH-的数目为NA | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成O.l NA个胶体粒子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 |
| CH4O | C2H4O2 | C4H8O2 | C5H12O | C6H12O2 |
| A. | 表格中的有机物1不可能与金属钠反应 | |
| B. | 空格中的有机物的同分异构体数目为3 | |
| C. | 空格中有机物燃烧一定生成CO2和H2O | |
| D. | 表格中2、4、6有机物不可能为同类物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com