
【题目】二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)。
(1)在373K时,向10 L的密闭容器中通入SO2、SCl2与Cl2均为0.20 mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
I | p | 6.0p0 | 6.7 p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①该反应的ΔH ______________(填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)= ______________。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是__________________。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为______________。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______________点。
(3)已知反应S4(g) +4Cl2(g) = 4SCl2(g) 的ΔH=-4kJ·mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJspan>、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________kJ
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为 Ka1= 1.54×10-2 、Ka2 = 1.02×10-7。10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)___________c(OH-)(大于、小于、等于,下同)
②当V= a mL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO32-)+c(HSO3-);当V= b mL时,溶液中离子浓度有如下关系:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3);则a _________b。
【答案】 < 0 5×10-3 molL-1min-1 加入了催化剂 2.6 B、E 243 大于 大于
【解析】试题分析:(1)反应达到平衡时的压强小于开始时的压强,物质的量减小,但开始1 min时压强大于开始的压强,说明容器内温度升高;根据同温同压下,压强比等于物质的量比,可知平衡时气体的物质的量是![]() ,利用“三段式” 计算v(SOCl2);由表格数据可以看出,改变条件反应速率加快,但平衡没移动。(2)根据(1)计算反应平衡常数;根据(1)可知SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)反应放热,升高温度平衡逆向移动,平衡常数减小;(3)根据焓变=反应物总键能-生成物总键能计算1molCl2(g)分子中化学键断裂时需吸收的能量;(4)10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=10mL时,溶质是NaHSO3,c(SO32-)>c(H2SO3),说明HSO3-电离大于水解;V= a mL时,根据电荷守恒c(Na+)=2c(SO32-)+c(HSO3-),说明c(H+)=c(OH-),溶液呈中性;V= b mL时c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),说明钠元素与硫元素的比为1:1,亚硫酸与氢氧化钠1:1反应,溶质是NaHSO3,溶液呈酸性;根据以上分析回答。
,利用“三段式” 计算v(SOCl2);由表格数据可以看出,改变条件反应速率加快,但平衡没移动。(2)根据(1)计算反应平衡常数;根据(1)可知SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)反应放热,升高温度平衡逆向移动,平衡常数减小;(3)根据焓变=反应物总键能-生成物总键能计算1molCl2(g)分子中化学键断裂时需吸收的能量;(4)10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=10mL时,溶质是NaHSO3,c(SO32-)>c(H2SO3),说明HSO3-电离大于水解;V= a mL时,根据电荷守恒c(Na+)=2c(SO32-)+c(HSO3-),说明c(H+)=c(OH-),溶液呈中性;V= b mL时c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),说明钠元素与硫元素的比为1:1,亚硫酸与氢氧化钠1:1反应,溶质是NaHSO3,溶液呈酸性;根据以上分析回答。
解析:(1)①气体物质的量减小,反应达到平衡时的压强小于开始时的压强,但开始1 min时压强大于开始的压强,说明容器内温度升高,所以正反应放热ΔH<0;②根据同温同压下,压强比等于物质的量比,可知平衡时气体的物质的量是![]() ,
,
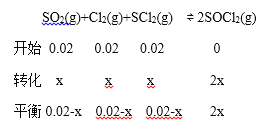
0.02-x+0.02-x+0.02-x+2x=0.05
x=0.01mol/L
v(SOCl2)= ![]() 5×10-3 molL-1min-1 ;③由表格数据可以看出,改变条件反应速率加快,但平衡没移动,所以可能是加入了催化剂。(2)①根据(1)的“三段式”
5×10-3 molL-1min-1 ;③由表格数据可以看出,改变条件反应速率加快,但平衡没移动,所以可能是加入了催化剂。(2)①根据(1)的“三段式”
平衡常数K=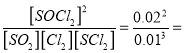 400,A点的数值
400,A点的数值![]() 2.6;②SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)反应放热,升高温度平衡逆向移动,平衡常数减小,所以
2.6;②SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)反应放热,升高温度平衡逆向移动,平衡常数减小,所以![]() 减小,选BE;(3)设1molCl2(g)分子中化学键断裂时需吸收的能量为xKJ,则-4=1064+4x-510kJ×4,解得x=243;(4)10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=10mL时,溶质是NaHSO3,c(SO32-)>c(H2SO3),说明HSO3-电离大于水解,则c(H+)大于c(OH-);V= a mL时, c(Na+)=2c(SO32-)+c(HSO3-),根据电荷守恒,说明c(H+)=c(OH-),溶液呈中性;V= b mL时c(Na+)=c(SO32-)+c(
减小,选BE;(3)设1molCl2(g)分子中化学键断裂时需吸收的能量为xKJ,则-4=1064+4x-510kJ×4,解得x=243;(4)10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=10mL时,溶质是NaHSO3,c(SO32-)>c(H2SO3),说明HSO3-电离大于水解,则c(H+)大于c(OH-);V= a mL时, c(Na+)=2c(SO32-)+c(HSO3-),根据电荷守恒,说明c(H+)=c(OH-),溶液呈中性;V= b mL时c(Na+)=c(SO32-)+c(


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】化学科学与材料、人体健康和环境保护等密切相关。
(1) 材料是人类社会发展的重要物质基础。
①高炉炼铁和生产硅酸盐水泥都要用到的原料是________(填字母)。
a. 黏土 b. 石灰石 c. 焦炭
②铝合金制品用途广泛。下列有关铝合金的性质正确的是________(填字母)。
a. 耐腐蚀 b. 强度小 c. 密度大
③玻璃钢具有质轻、电绝缘性好、强度大等特点。玻璃钢属于________(填字母)。
a. 金属材料 b. 无机非金属材料 c. 复合材料
(2) 合理饮食和正确用药,是人体健康的重要保证。现有下列五种物质A. 食盐 B. 小苏打 C. 苹果汁 D. 葡萄糖 E. 青霉素,
请按下列要求填空(填序号)。
富含维生素C的是____________;可直接进入血液,补充能量的是________;应用最广泛的抗生素之一的是________;既可作为疏松剂,又可治疗胃酸过多的是________;食用过多会引起血压升高、肾脏受损的是________。
(3) 治理环境污染、改善生态环境已成为全人类的共识。
①在煤中加入适量的石灰石作脱硫剂,可以减少________型酸雨的发生。脱硫后产生的废料中含有的________(填化学式)可用于制造建筑材料。
②天然水中的杂质较多,常需加入明矾、氯化铁、漂白粉等处理后才能作为生活用水,氯化铁净水原理的离子方程式为________________。漂白粉能杀菌消毒,其有效成分是________________(填化学式)。
③某工业废水中含有的铊(Tl+)具有高毒性,处理时常加入NaClO溶液,将Tl+转化为Tl3+,该反应中氧化剂是________(填“Tl+”或“NaClO”),同时加入适量氨水以调节水体的pH,从而将Tl3+转化为难溶的________(填化学式)沉淀除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________________________。
(2)烧杯间填满碎纸条的作用是________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)如果用50mL0.50mol/L硝酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能使反应Cu+2H2O=Cu(OH)2↓+H2↑发生且Cu(OH)2能在电极上析出的是( )
A.铜片作原电池负极,碳棒为正极,NaCl溶液作电解质溶液
B.用铜片作阴、阳极,电解Na2SO4水溶液
C.铜片作阴、阳极,电解NaOH水溶液
D.铜片作阴、阳极,电解CuSO4水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素和硫元素组成的两种物质发生化学反应的微观示意图如下所示,其中●表示硫原子,○表示氧原子. 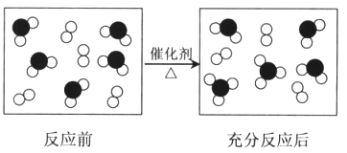
请回答下列问题:
(1)该反应的化学方程式是 .
(2)反应过程中,O2的浓度在5min内由5mol/L变成了1mol/L,用O2表示的化学反应速率是mol/(Lmin).
(3)在等温等容条件下,该反应达到化学平衡状态的依据是(填序号).
a.容器中压强不再改变
b.混合气体中c(O2)不再改变
c.c(SO2)=c(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 化学键存在所有单质和化合物中
B. 化学键的断裂和形成是化学反应能量变化的主要原因
C. 只要有能量变化,则一定发生了化学反应
D. 当反应物的总能量低于生成物的总能量时,该反应放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硬水的下列叙述中,错误的是( )
A.硬水中的Ca2+、Mg2+离子可阻碍肥皂起泡
B.用漂白粉对自来水消毒,会增加水的硬度
C.向硬水中加入明矾,可以使硬水软化
D.雨水的硬度比海水的硬度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、环境密切相关,下列有关说法不正确的是
A.使用太阳能代替化石燃料,能减少温室气体的排放。
B.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物
C.食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质
D.对“地沟油’’蒸馏可以获得汽油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com