
| A. | 二氧化碳和澄清石灰水反应 | B. | 实验室用双氧水制取氧气 | ||
| C. | 碳酸氢钠受热分解 | D. | 氧化铜和稀硫酸反应 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主要成分为NaCl、NaClO和NaHCO3 | B. | c(Cl-)=c(ClO-) | ||
| C. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)=c(Cl-)+c(ClO-)+2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 .
. .
.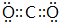 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为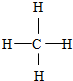 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 | 实验目的 | |
| A | 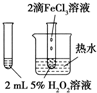 | 验证FeCl3对H2O2分解反应有催化作用 |
| B | 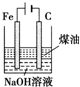 | 制备Fe(OH)2并能较长时间观察其颜色 |
| C | 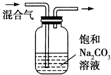 | 除去CO2气体中混有的SO2 |
| D | 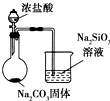 | 比较Cl、C和Si的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)=0.1 mol•L-1 | |
| B. | 0.2 mol•L-1NaHS溶液和0.1 mol•L-1Na2S溶液等体积混合,混合液中:3c(Na+)=4c(H2S)+4c(HS-)+4c(S2-) | |
| C. | KAl(SO4)2的水溶液中:c(SO42-)>c(A13+)>c(K+)>c(H+)>c(OH-) | |
| D. | H2SO3溶液中:c(H+)=2c(SO32-)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com