
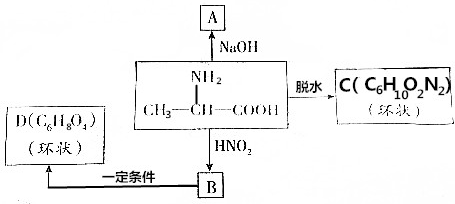
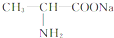 、C
、C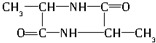 .
.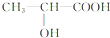 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$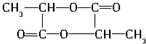 +2H2O.
+2H2O. B.
B.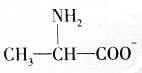
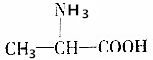 D.
D.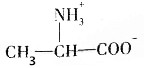
分析 氨基酸能发生缩聚反应,脱去一个H2O分子,即-COOH脱去-OH,-NH2脱去-H,发生缩聚反应生成蛋白质,由此结合C的分子式可推知,2个丙氨酸分子间脱去2个H2O分子生成环状C为 .丙氨酸与氢氧化钠发生中和反应生成A为
.丙氨酸与氢氧化钠发生中和反应生成A为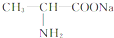 .由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得B为
.由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得B为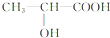 ,2分子B脱去2分子水生成环状产物D,故D的结构简式为
,2分子B脱去2分子水生成环状产物D,故D的结构简式为 ,据此解答.
,据此解答.
解答 解:氨基酸能发生缩聚反应,脱去一个H2O分子,即-COOH脱去-OH,-NH2脱去-H,发生缩聚反应生成蛋白质,由此结合C的分子式可推知,2个丙氨酸分子间脱去2个H2O分子生成环状C为 .丙氨酸与氢氧化钠发生中和反应生成A为
.丙氨酸与氢氧化钠发生中和反应生成A为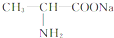 .由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得B为
.由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得B为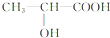 ,2分子B脱去2分子水生成环状产物D,故D的结构简式为
,2分子B脱去2分子水生成环状产物D,故D的结构简式为 .
.
(1)根据以上分析,A、C的结构简式分别为: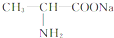 、
、 ,
,
故答案为: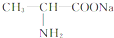 、
、 ;
;
(2)根据以上分析,2分子B脱去2分子水生成环状产物D,则C→E的化学方程式:2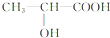 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为:2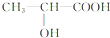 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;
(3)-COOH具有酸性,-NH2具有碱性,当溶液强碱性时,存在大量的氢氧根离子,羧基会被中和为羧酸盐,而氨基不反应,所以羧基的存在形式是-COO-,即B符合,
故答案为:B.
点评 本题考查有机物推断以及常见物质的化学性质的应用,涉及氨基酸性质与转化,注意根据氨基、羧基性质以及给予的信息进行推断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 油脂皂化反应得到高级脂肪酸与甘油 | |
| C. | 用甘氨酸(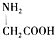 )和丙氨酸( )和丙氨酸(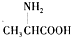 )的混合物在一定条件下可形成四种链状二肽 )的混合物在一定条件下可形成四种链状二肽 | |
| D. | 实验证实 可使溴的CCl4溶液褪色,说明该分子中够存在碳碳双键 可使溴的CCl4溶液褪色,说明该分子中够存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质与氨基酸一样也是两性分子,既能与酸反应,又能与碱反应 | |
| B. | 豆浆中富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 浓Na2SO4溶液能使蛋白质溶液中的蛋白质析出,加水后析出的蛋白质又溶解,但已失去生理活性 | |
| D. | 核酸是由C、H、0、P、N等元素组成的小分子有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| B. | 制镁:用海水为原料,经一系列过程制得氯化镁固体,电解熔融的氯化镁得镁 | |
| C. | 制铁:以铁矿石为原料,CO还原得铁 | |
| D. | 制铝:从铝土矿中获得氧化铝,提纯后电解熔融的氧化铝得到铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①④ | C. | ①③ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com