
| A. | 按照有机物系统命名法,化合物的名称为:3,3-二乙基戊烷 | |
| B. | 分子式为C4H8O2的所有酯类的同分异构体共有6种 | |
| C. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧消耗氧气的量相同 | |
| D. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,但它们与足量的氢气充分反应后的产物是同系物 |
分析 A.依据名称写出结构简式,结合系统命名法分析判断正误;
B.C4H8O2属于酯类的同分异构体,为饱和一元酯,根据形成酯的酸和醇的种类来确定;
C.乙烯的分子式为C2H4,碳酸二甲酯(CH3OCOOCH3)的分子式可写成C2H4•CO2•H2O;
D.含双键数目不同,均可与氢气发生加成反应生成饱和一元羧酸.
解答 解:A.化合物的名称为:3,3-二乙基戊烷,CH3-CH2-C(CH3CH2)2-CH2-CH3,符合系统命名法,故A正确;
B.C4H8O2属于酯类的同分异构体,为饱和一元酯,
若为甲酸与丙醇形成的酯,甲酸只有1种结构,丙醇有2种,形成的酯有2种,
若为乙酸与乙醇形成的酯,乙酸只有1种结构,乙醇只有1种结构,形成的乙酸乙酯有1种,
若为丙酸与甲醇形成的酯,丙酸只有1种结构,甲醇只有1种结构,形成的丙酸甲酯只有1种,
所以C4H8O2属于酯类的同分异构体共有4种,故B错误;
C.乙烯的分子式为C2H4,碳酸二甲酯(CH3OCOOCH3)的分子式可写成C2H4•CO2•H2O,则等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧的耗氧量相同,故C正确;
D.含双键数目不同,均可与氢气发生加成反应生成饱和一元羧酸,则丙烯酸和山梨酸不是同系物,但加成产物是同系物,故D正确;
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,综合考查学习化学知识的应用能力,题目难度中等,注意把握有机物的官能团的性质、同分异构体书写为解答该题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
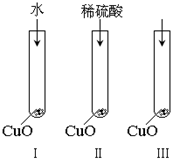 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解.请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解.请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、CO32-、Cl- | B. | K+、H+、Cl-、SO42- | ||
| C. | Na+、Cu2+、SO42-、OH- | D. | H+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H18O4 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H20O5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com