
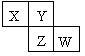
| A.原子半径:W>Z>Y>X |
| B.Y的气态氢化物的稳定性较Z的强 |
| C.W的最高价氧化物对应水化物的酸性较Z的强 |
| D.四种元素的单质中,Z的熔、沸点最高 |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.道尔顿——电子轨道理论 | B.卢瑟福——量子力学模型 |
| C.玻尔——行星绕太阳模型 | D.汤姆逊——葡萄干面包模型 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①>②>③>④ | B.③>④>①>② | C.③>①>②>④ | D.①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径 A>B>D>C | B.原子序数?d>c>b>a |
| C.离子半径 C>D>B>A | D.单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 学原理相
学原理相 同
同 s多4个
s多4个 质子
质子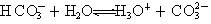
 的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
的非金属性逐渐减弱,故氢卤酸的酸性依次减弱 2NH3
2NH3 (g) △H=-38.6kJ·mol-1
(g) △H=-38.6kJ·mol-1| A.全部 | B.④⑤ | C.②③④⑦ | D.②④⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| X | | Y |
| | Z | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com