
| A. | 某离子结构示意图为: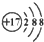 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式为: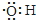 ,可以表示羟基,也可以表示氢氧根离子 ,可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型为: ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 晶体锗的结构为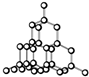 ,其晶胞可表示为 ,其晶胞可表示为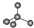 |
分析 A.质子数为17,为氯离子;
B.电子式为: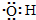 ,存在1个单电子可以表示羟基;
,存在1个单电子可以表示羟基;
C.比例模型中球的大小与原子半径有关;
D.晶体锗为金属晶体,晶体结构的基本单元是晶胞,不是球棍分子模型.
解答 解:A.某离子结构示意图为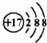 ,该离子的质子数为17,则可以表示35Cl-,也可以表示37Cl-,故A正确;
,该离子的质子数为17,则可以表示35Cl-,也可以表示37Cl-,故A正确;
B.电子式为: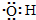 可以表示羟基,但不能表示氢氧根离子,离子带电荷,氢氧根离子的电子式为:
可以表示羟基,但不能表示氢氧根离子,离子带电荷,氢氧根离子的电子式为: ,故B错误;
,故B错误;
C.比例模型为: 可以表示甲烷分子,但不能表示四氯化碳分子,因Cl原子半径比C原子半径大,故C错误;
可以表示甲烷分子,但不能表示四氯化碳分子,因Cl原子半径比C原子半径大,故C错误;
D.晶体锗的结构为 ,其晶胞可表示为
,其晶胞可表示为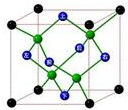 ,故D错误;
,故D错误;
故选A.
点评 本题考查化学用语,涉及离子结构示意图、电子式、比例模型、晶胞等,注意区别不同的化学用语并规范应用,注重基础知识的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素X的最高价氧化物对应水化物一定是强碱 | |
| C. | 元素Y是ⅢA族的元素 | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、焰色反应 | B. | Ba(OH)2溶液、焰色反应 | ||
| C. | 盐酸、加热 | D. | BaCl2溶液、焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 | |
| B. | 价电子排布式为5s25p1的元素位于第五周期第ⅠA族,是s区元素 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+.
NH3•H2O+H+. 2NH3(g)△H=-2a kJ mol-1.
2NH3(g)△H=-2a kJ mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
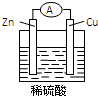 Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.
Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
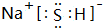 ,B中含有的化学键类型是离子键、共价键.
,B中含有的化学键类型是离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-15 | 4.0×10-38 |
| 完全沉淀时的pH | ≥5.0 | ≥5.5 | ≥4.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com