
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
分析 A.升高温度正逆反应速率都增大,平衡向逆反应方向移动,说明温度对逆反应速率影响较大;
B.增大压强,平衡正向移动,则压强对正反应速率影响较大;
C.减小反应物浓度,逆反应速率不变;
D.加入催化剂,对正逆反应速率影响相同.
解答 解:A.该反应的正反应是放热反应,升高温度正逆反应速率都增大,但平衡向逆反应方向移动,说明温度对逆反应速率影响较大,故A错误;
B.该反应的正反应是反应前后气体体积减小的反应,增大压强,平衡正向移动,则压强对正反应速率影响较大,故B正确;
C.减小反应物浓度,生成物浓度不变,则逆反应速率不变,故C错误;
D.加入催化剂,对正逆反应速率影响相同,所以正逆反应速率仍然相等,故D错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确外界条件对化学平衡影响原理是解本题关键,注意结合反应特点分析,注意:催化剂影响反应速率但不影响平衡移动.


科目:高中化学 来源: 题型:选择题
| A. | 仅① | B. | 仅①② | C. | 仅①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类物质都有甜味 | B. | 糖类物质的组成都符合通式Cm(H2O)n | ||
| C. | 动植物的生命活动都需要糖 | D. | 糖类都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HCl的物质的量浓度 (mol•L-1) | BOH的物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
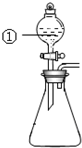 用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )| 选项 | ①中物质 | 锥形瓶中物质 | 预测锥形瓶中的现象 |
| A | 浓盐酸 | “84”消毒液 | 有黄绿色气体产生 |
| B | 浓硝酸 | 光洁的铁钉 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 先有白色沉淀生成, 后沉淀又溶解 |
| D | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色, 有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中混有的乙酸,可以加入Na2CO3溶液,再分液 | |
| B. | 将SO2通入滴有酚酞的NaOH溶液中,溶液褪色,可以证明SO2具有漂白性 | |
| C. | 用金属钠分别与水和乙醇反应,可比较水分子中氢原子和乙醇羟基中氢原子的活泼性 | |
| D. | 先加盐酸酸化,再加入BaCl2溶液,生成白色沉淀,可确定该溶液中含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com