

A.45 mL B.30 mL C.15 mL D.60 mL
解析:本题考查铝盐与强碱溶液作用生成Al(OH)3的计算。
(1)反应关系:
Al3++3OH-![]() Al(OH)3↓生成白色沉淀
Al(OH)3↓生成白色沉淀
Al(OH)3+OH-![]()
![]() +2H2O沉淀溶解
+2H2O沉淀溶解
Al3++4OH-![]()
![]() +2H2O沉淀恰好完全溶解
+2H2O沉淀恰好完全溶解
(2)根据上述反应关系,可进行Al(OH)3沉淀量的快速计算
①当n(OH-)∶n(Al3+)<3∶1时,Al3+未完全沉淀,Al(OH)3的沉淀量只由nOH-决定,即:
n〔Al(OH)3〕=![]() n(OH-) [3OH-—Al(OH)3]
n(OH-) [3OH-—Al(OH)3]
②当n(OH-)∶n(Al3+)=3∶1时,两者恰好反应生成Al(OH)3沉淀,则n〔Al(OH)3〕=![]() n(OH-)=n(Al3+) [Al3+—3OH-—Al(OH)3]
n(OH-)=n(Al3+) [Al3+—3OH-—Al(OH)3]
③当n(OH-)∶n(Al3+)>3∶1但小于4∶1,沉淀会部分溶解,Al(OH)3的沉淀量等于最大量减去溶解量,由Al(OH)3+OH-![]()
![]() +2H2O知溶解量等于过量的OH-的物质的量即n(总OH-)-3n(Al3+),所以Al(OH)3的沉淀量n〔Al(OH)3〕=n(Al3+)-[n(总OH-)-3n(Al3+)]=4n(Al3+)-n(总OH-)。
+2H2O知溶解量等于过量的OH-的物质的量即n(总OH-)-3n(Al3+),所以Al(OH)3的沉淀量n〔Al(OH)3〕=n(Al3+)-[n(总OH-)-3n(Al3+)]=4n(Al3+)-n(总OH-)。
④当n(OH-)∶n(Al3+)≥4∶1,强碱过量到将生成的Al(OH)3全部溶解,此时n〔Al(OH)3〕=0。
因产生的Al(OH)3可以溶解在过量的NaOH溶液中,所以产生
Al3+—3OH-—Al(OH)3↓
V1=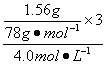 =
=
V2=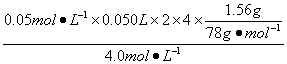 =45 mL
=45 mL
答案:AC


科目:高中化学 来源: 题型:
A.1 mol·L-1 B.0.55 mol·L-1
C.0.67 mol·L-1 D.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:

图4-10
A.45 mL B.30 mL C.15 mL D.60 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
将50 mL 0.1 mol·L-1 NaCl和50 mL 0.5 mol·L-1 CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为( )
A.1 mol·L-1 B.0.55 mol·L-1
C.0.67 mol·L-1 D.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省永昌一中高一上学期期中考试化学试卷(带解析) 题型:计算题
(6分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_________?
(2)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为_______。
(3)将50 mL 0.1 mol·L-1 NaCl和50 mL 0.5 mol·L-1 CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c (Cl-)为?______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com