
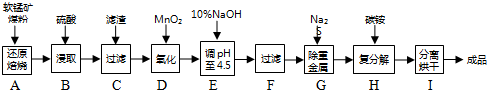
分析 软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,
(1)步骤D中酸性溶液中Fe2+被MnO2氧化为铁离子,二氧化锰被还原生成锰离子;
(2)步骤H是硫酸锰和碳酸氢铵反应,碳酸氢根离子过量,所以锰离子结合碳酸根离子生成碳酸锰沉淀,氢离子浓度增大和过量的碳酸氢根离子反应生成二氧化碳气体;
(3)当溶液中c(Pb2+)=1×10-5mol•L-1时沉淀完全,计算硫离子浓度,结合硫化锰溶度积计算锰离子的最大浓度;
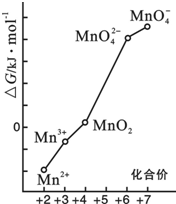
(4)①若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒,则依据图象分析判断,MnO42-在MnO4-和MnO2之间;
②将Mn3+歧化反应得到Mn2+和MnO2,2Mn3++2H2O=MnO2+Mn2++4H+,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
③MnO4-溶液中呈紫红色,检验时必须控制Mn2+浓度和用量不能过大过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察;
解答 解:(1)步骤D中酸性溶液中Fe2+被MnO2氧化为铁离子,二氧化锰被还原生成锰离子,反应的离子方程式为:2Fe2++MnO2+4H+═2Fe2++Mn2++2H2O,
故答案为:2Fe2++MnO2+4H+═2Fe2++Mn2++2H2O;
(2)步骤H是硫酸锰和碳酸氢铵反应,碳酸氢根离子过量,所以锰离子结合碳酸根离子生成碳酸锰沉淀,氢离子浓度增大和过量的碳酸氢根离子反应生成二氧化碳气体,反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(3)已知Ksp(PbS)=1×10-28,当溶液中c(Pb2+)=1×10-5mol•L-1时,c(S2-)=$\frac{1×1{0}^{-28}}{1×1{0}^{-5}}$=10-23mol/L,Ksp(MnS)=1×10-9.6,溶液中c(Mn2+)允许的最大值=$\frac{1×1{0}^{-9.6}}{1{0}^{-23}}$=1×1013.4 mol•L-1,
故答案为:1×1013.4 mol•L-1;
(4)①若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒,则依据图象分析判断,MnO42-在MnO4-和MnO2之间,则MnO42-在pH=0的溶液中不能稳定存在,
故答案为:不能;
②将Mn3+歧化反应得到Mn2+和MnO2,2Mn3++2H2O=MnO2+Mn2++4H+,设计为原电池反应,电池负极反应为Mn3+失电子发生氧化反应生成Mn2+,电极反应为:Mn3++2H2O-e-=MnO2+4H+,平衡常数K=
$\frac{c(M{n}^{2+}){c}^{4}({H}^{+})}{{c}^{2}(M{n}^{3+})}$故答案为:Mn3++2H2O-e-=MnO2+4H+,$\frac{c(M{n}^{2+}){c}^{4}({H}^{+})}{{c}^{2}(M{n}^{3+})}$;
③MnO4-溶液中呈紫红色,检验时必须控制Mn2+浓度和用量不能过大过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察,
故答案为:溶液呈紫红色;过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察;
点评 本题考查了物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
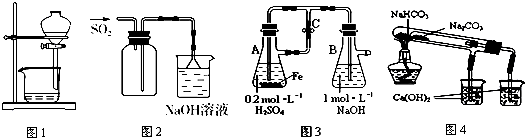
| A. | 图1用于放出碘的苯溶液 | |
| B. | 图2用于实验室收集SO2 | |
| C. | 图3用于实验室制备Fe(OH)2 | |
| D. | 图4用于比较NaHCO3和Na2CO3热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的阳离子的氧化性比A的阳离子强,则A元素的金属性不一定比B元素强 | |
| B. | 发生氧化还原反应时,A原子失去的电子比B原子多,证明A的金属性一定比B强 | |
| C. | 适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2═2FeCl3+4FeI3 | |
| D. | A的金属性比B的金属性强,则A一定可以在水溶液置换出B来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为75.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向正反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04 p总 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N-N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N-N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )| A. | N4与N2互为同素异形体 | |
| B. | 1 mol N4气体转化为N2时要放出724 kJ能量 | |
| C. | N4变成N2是化学变化 | |
| D. | N4不可能是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com