
 .
.分析 A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,B的氢化物H2B是一种最常见的无色液体,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属,则C、D最外层电子数分别为4、1,故A为C元素,C为Si元素,D为Na元素,E的原子半径介于C、O之间,可推知E为N元素,据此解答.
,B的氢化物H2B是一种最常见的无色液体,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属,则C、D最外层电子数分别为4、1,故A为C元素,C为Si元素,D为Na元素,E的原子半径介于C、O之间,可推知E为N元素,据此解答.
解答 解:A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,B的氢化物H2B是一种最常见的无色液体,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属,则C、D最外层电子数分别为4、1,故A为C元素,C为Si元素,D为Na元素,E的原子半径介于C、O之间,可推知E为N元素.
,B的氢化物H2B是一种最常见的无色液体,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属,则C、D最外层电子数分别为4、1,故A为C元素,C为Si元素,D为Na元素,E的原子半径介于C、O之间,可推知E为N元素.
(1)C为Si元素,在元素周期表的第三周期ⅣA族,故答案为:三、ⅣA;
(2)在五种元素中,能形成的最简单的液态或气态氢化物有H2O、NH3、CH4、SiH4,由于非金属性:O>N>C>Si,故氢化物稳定性:H2O>NH3>CH4>SiH4,
故答案为:H2O>NH3>CH4>SiH4;
(3)A与B形成的三原子分子为CO2,结构式是O=C=O,B与D形成的原子个数比为1:1的化合物为Na2O2,电子式是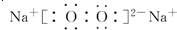 ,
,
故答案为:O=C=O;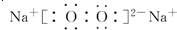 ;
;
(4)反应2H2(g)+O2(g)=2H2O(l) 的△H=2×a kJ/mol+bkJ/mol-4×c kJ/mol=-(4c-2a-b)kJ/mol,1gH2为0.5mol,在B2中完全燃烧放出的热量为(4c-2a-b)kJ/mol×$\frac{0.5mol}{2mol}$=$\frac{(4c-2a-b)}{4}$kJ,
故答案为:$\frac{(4c-2a-b)}{4}$kJ;
(5)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1:2,分子式为N2H4,正极发生还原反应,且电解质呈碱性,氧气得电子生成氢氧根离子,电极方程式为O2+2H2O+4e-═4OH-,
故答案为:O2+2H2O+4e-═4OH-.
点评 本题考查元素位置结构性质的关系,题目难度中等,关键是正确推断元素的种类,注意根据原子位置关系及半径大小找出其在周期表中的相对位置.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:填空题
 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:
)俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:

 ;
;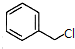 +
+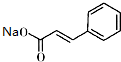 $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$ +NaCl;
+NaCl; (写结构简式,若有多种可能,只写一种).
(写结构简式,若有多种可能,只写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往某固体中滴加稀盐酸有气泡产生--该固体一定是碳酸盐 | |
| B. | 往某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀--该溶液一定含有硫酸根离子 | |
| C. | 生石灰块投入水中,水会沸腾--生石灰变成熟石灰的过程是放热反应 | |
| D. | 往品红溶液中通入某种气体,使品红褪色--该气体一定是二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯能使酸性KMnO4溶液褪色 | |
| B. | 苯与稀硝酸、稀硫酸混合加热,生成硝基苯 | |
| C. | 苯与溴水混合振荡,静置,下层液体几乎为无色 | |
| D. | 1mol苯与2mol氢气发生加成反应生成1mol环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com