
| A. | 标准状况下,2.24L乙醇分子所含的C-H键数为0.5NA | |
| B. | 3.2克O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的Al2(SO4)3溶液中,AL3+的数目小于0.2NA | |
| D. | 0.1molFe参加氧化还原反应,转移的电子数目一定是0.3NA |
分析 A、标况下乙醇为液态;
B、氧气和臭氧均由氧原子构成;
C、溶液体积不明确;
D、铁参与反应后的价态不明确.
解答 解:A、标况下乙醇为液态,故不能根据气体摩尔体积来计算其物质的量和C-H键个数,故A错误;
B、氧气和臭氧均由氧原子构成,故3.2g混合物中含有的氧原子的物质的量为n=$\frac{3.2g}{16g/mol}$=0.2mol,故含有的氧原子为0.2NA个,故B正确;
C、溶液体积不明确,故溶液中的铝离子的个数无法计算,故C错误;
D、铁参与反应后的价态不明确,可能为+2价,也可能为+3价,故转移的电子数不一定是0.3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题

| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
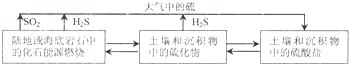
| 25℃ | 饱和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(开始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L空气中O2、N2分子数为NA | |
| B. | 0.1mol羟基中所含电子数目为NA | |
| C. | 钠与氧气反应时,每消耗4.6g钠时生成的阴离子数目为0.1NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液显弱酸性 | |
| B. | 该溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法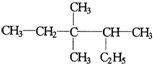 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 | |
| B. | 乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应 | |
| C. | 分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com