
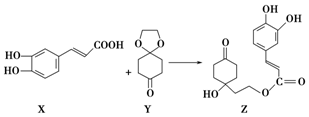
| A. | X的分子式为C9H8O4 | |
| B. | Y、Z中均含1个手性碳原子 | |
| C. | Z能发生加成反应、取代反应及消去反应 | |
| D. | 1 mol Z至多可与3 mol Br2发生取代反应 |
分析 A.由结构简式可知分子式;
B.连4个不同基团的碳原子为手性碳原子;
C.Z中含-OH、C=O、碳碳双键、酚-OH及-COOC-;
D.Z中酚-OH的邻对位与溴发生取代,碳碳双键与溴发生加成反应.
解答 解:A.由结构简式可知分子式为C9H8O4,故A正确;
B.连4个不同基团的碳原子为手性碳原子,X中不含手性碳,而Y中含1个手性C(与两个O均相连的C),故B错误;
C.Z中含C=O、碳碳双键能发生加成反应,含酚-OH及-COOC-可发生取代反应,含醇-OH,可发生消去反应,故C正确;
D.Z中酚-OH的邻对位与溴发生取代,则1molZ至多可与3molBr2发生取代反应,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、醇、烯烃、酯性质的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 断开化学键的过程会放出能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 酸碱中和反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2、Al2O3、CuO都是碱性氧化物 | |
| B. | 纯碱、烧碱均属碱类 | |
| C. | NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 | |
| D. | HCl、CH3COOH、HNO3都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从食盐溶液中获得食盐晶体采用蒸馏的方法 | |
| B. | 将碘晶体中含有的少量沙子除去采用蒸馏的方法 | |
| C. | 除去酒精中含有的较多量水采用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9mL | B. | 小于9mL | ||
| C. | 大于9 mL | D. | 因操作错误无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com