
| ��ѧʽ | ����ƽ�ⳣ����25�棩 |
| HCN | K=4.9��10-10 |
| H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |

���� I����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ•mol-1 ����Ӧʱ���������С�ķ��ȷ�Ӧ����Ӧ�ﵽƽ��ı�־�����淴Ӧ������ͬ�����ɷֺ������ֲ��䣬����ѡ�
������ͼ��������������̼�ķ�Ӧ���ʣ���Ϸ�Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȼ��������ķ�Ӧ���ʣ�
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ•mol-1��a��0������Ӧ�����������С�ķ��ȷ�Ӧ�����ƽ���ƶ��������ж���ʹ$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$����ѡ�
�ܼ���ƽ��Ũ�ȼ��㷴Ӧƽ�ⳣ����ƽ�ⳣ������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻���
��25��ʱ�����HCN��NaCN�Ļ����Һ��pH=11��$\frac{c��HCN��}{c��C{N}^{-}��}$=$\frac{c��HCN��}{c��C{N}^{-}��}$��$\frac{c��{H}^{+}��}{c��{H}^{+}��}$=$\frac{c��{H}^{+}��}{Ka}$��
��̼���һ�����볣������HCN�ģ��������볣��С��HCN�ģ���̼�������ǿ��HCN��Ϊ̼���������������HCN������NaCN��Һ��ͨ������CO2����Ӧ����HCN��NaHCO3��
��1�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ��
��2��������ԭ���װ��ͼ���������������������������MΪԭ��ظ�����NΪ�����������Ǽ״�ȼ��ʧ���������Խ��������ɶ�����̼���ݴ���д�缫��Ӧ��
�ڵ�ⱥ��ʳ��ˮ�����������������������ƣ���ϻ�ѧ����ʽ��д���ӷ���ʽ�����ݵ����غ�������ļ״�������
��� �⣺��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ•mol-1��a��0������Ӧ�����������С�ķ��ȷ�Ӧ��
A��CO2����������ڻ�������б��ֲ��䣬��ƽ���־����A�����ϣ�
B��ƽ�������������䣬��Ӧǰ���������ʵ�����С����������ƽ����Է�����������ʱ��ı仯���仯��˵����Ӧ�ﵽƽ�⣬��B�����ϣ�
C����λʱ����ÿ����1.2mol H2��ͬʱ����0.4mol H2O���ܱ�ʾ��Ӧ���淴Ӧ������ͬ����˵����Ӧ�ﵽƽ�⣬��C�����ϣ�
D����ѧ����ʽ������ϵ��֪����Ӧ�����к�ƽ��״̬�£���Ӧ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ��䣬����˵����Ӧ�ﵽƽ�⣬��D���ϣ�
�ʴ�Ϊ��D��
��ͼ�������֪������̼�ķ�Ӧ����V��CO2��=$\frac{1.00mol/L-0.75mol/L}{10min}$=0.025mol/L•min��
��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�V��H2��=3V��CO2��=3��0.025mol/L•min=0.075 mol•L-1•min-1��
�ʴ�Ϊ��0.075 mol•L-1•min-1��
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ•mol-1��a��0������Ӧ�����������С�ķ��ȷ�Ӧ��
A����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������У�ʹ$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$����A�����ϣ�
B����H2O��g������ϵ�з��룬ƽ��������У�ʹ$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$����B�����ϣ�
C�����º����³���He��g������ѹ����ѹ���䣬ƽ�ⲻ����ʹ$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$���䣬��C���ϣ�
D�����º����ٳ���2mol CO2��3mol H2 ������ѹǿƽ��������У�ʹ$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$����D�����ϣ�
�ʴ�Ϊ��C��
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ����mol/L�� 1 1.5 0 0
�仯����mol/L�� 0.25 0.75 0.25 0.25
ƽ������mol/L�� 0.75 0.75 0.25 0.25
ƽ�ⳣ��K=$\frac{0.25��0.25}{0.75��0.7{5}^{3}}$��0.20 L2/mol2��
�ʴ�Ϊ��0.20 L2/mol2��
��25��ʱ�����HCN��NaCN�Ļ����Һ��pH=11��$\frac{c��HCN��}{c��C{N}^{-}��}$=$\frac{c��HCN��}{c��C{N}^{-}��}$��$\frac{c��{H}^{+}��}{c��{H}^{+}��}$=$\frac{c��{H}^{+}��}{Ka}$=$\frac{1{0}^{-11}}{4.9��1{0}^{-10}}$=$\frac{1}{49}$��
�ʴ�Ϊ��$\frac{1}{49}$��
��̼���һ�����볣������HCN�ģ��������볣��С��HCN�ģ���̼�������ǿ��HCN��Ϊ̼���������������HCN������NaCN��Һ��ͨ������CO2����Ӧ����HCN��NaHCO3���÷�Ӧ���ӷ���ʽΪ��CN-+CO2+H2O=HCN+HCO3-��
�ʴ�Ϊ��CN-+CO2+H2O=HCN+HCO3-��
��1����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ•mol-1��
��CH3OH��g���TCH3OH��l����H=-b kJ•mol-1��
��2H2��g��+O2��g���T2H2O��l����H=-c kJ•mol-1��
���ݸ�˹���ɼ���ۡ�$\frac{3}{2}$-��-�ڵõ���ʾCH3OH��l��ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-��$\frac{3}{2}$c-a-b��kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-��$\frac{3}{2}$c-a-b��kJ•mol-1��
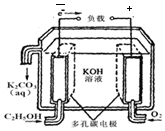
��2��������ԭ���װ��ͼ���������������������������MΪԭ��ظ�����NΪ�����������Ǽ״�ȼ��ʧ���������Խ��������ɶ�����̼���缫��ӦΪCH3OH-6e-+H2O=CO2+6H+��
�ʴ�Ϊ��CH3OH-6e-+H2O=CO2+6H+��
�ڵ�ⱥ��ʳ��ˮ�����������������������ƣ���ϻ�ѧ����ʽ��д���ӷ���ʽΪ��2Cl-+2H2O $\frac{\underline{\;ͨ��\;}}{\;}$H2��+Cl2��+2 OH-��
��Һ���Ϊ300mL������Һ��pHֵΪ13ʱ����Һ������������Ũ��c��OH-��=0.1mol/L�������������������ʵ���=�������������ʵ���=0.1mol/L��0.3L=0.03mol�����ݵ缫��Ӧ�͵����غ���㣬CH3OH-6e-+H2O=CO2+6H+��2H++2e-=H2����CH3OH��6H+���״����ʵ���=0.005mol������=0.005mol��32g/mol=0.16g��
�ʴ�Ϊ��0.16��
���� ���⿼�����Ȼ�ѧ����ʽ��˹���ɼ��������ѧƽ��Ӱ�����أ�ƽ���ƶ�ԭ���ķ����жϣ�ע��ͼ�����Ӧ�ã�ԭ��ء�����ԭ���ķ����жϣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˫��ˮ | B�� | ���Ȼ�̼ | C�� | ���� | D�� | ������̼  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HA�ĵ���ƽ�ⳣ��ΪKa=1.0��10-7 | |
| B�� | ���μ�10 mLMOH ��Һʱ��������Һ������ | |
| C�� | ������20 mL MOH ��Һʱ����Һ���У�c��MOH��+2c��OH-��=c��A-��+c��H+��+2c��HA�� | |
| D�� | ������������MOH��Һʱ���ٽ���HA�ĵ��룬��Һ��pH���ߣ�������MOH��������$\frac{c��{A}^{-}��}{c��HA��}$��ֵ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬŨ�ȡ�ͬ�����ǿ����ǿ����Һ��Ϻ���Һ�� pH һ������ 7 | |
| B�� | 0.1 mol•L-1 NH4Cl ��Һ�� 0.1 mol•L-1��ˮ�������ϣ�pH��7����c��NH3•H2O����c��NH4+����c��Cl-����c��OH-�� | |
| C�� | �� 0.10 mol•L-1Na2SO3��Һ��ͨ SO2 ��������Һ pH=7��c��Na+���T2c��SO32-��+c��HSO3-�� | |
| D�� | 0.1 mol AgCl �� 0.1 mol AgBr ��Ϻ����ˮ�У�������Һ c��Cl-���Tc��Br-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 SO2��һ����������������������ص����壮��ش��������⣺
SO2��һ����������������������ص����壮��ش��������⣺| �ⶨʱ��/min | 0 | 3 | 6 | 10 | 15 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ͱ����ܶ���IA��Ԫ�� | |
| B�� | �����Ƿǽ������ʣ�����������ǽ��� | |
| C�� | .�ҺͶ����ܶ�Ϊ������ | |
| D�� | .�ҺͶ����ܶ�Ϊ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�4.48L���麬�еķ�����Ϊ0.2NA | |
| B�� | 0.1 molOD-���Ӻ��еĵ��ӡ���������Ϊ 1.0 NA | |
| C�� | һ�������£�0.1 mol N2��0.3mol H2��ַ�Ӧ���0.1NA������ | |
| D�� | �����ʵ���Ϊ0.1mol ��CaO�� CaC2������У�������������Ϊ0.2 NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com