
【题目】电解饱和食盐水是一项重要的化学工业,请完成下列计算:
(1)当电解产生0.2mol NaOH时,能收集到标准状况下的H2L.
(2)已知室温时饱和食盐水的溶质质量分数为0.265,取200g饱和食盐水进行电解,当NaCl反应了一半时停止电解,①求写出所得混合溶液中NaCl的质量,②求出所得混合溶液中NaOH的质量分数.(写出计算过程,保留3位小数)
【答案】
(1)2.24
(2)26.5g ; ![]() =0.099
=0.099
【解析】解:(1)电解池的阳极上是氯离子失电子产生氯气,阴极上是氢离子得电子生成氢气,电解氯化钠溶液的原理方程式为:2NaCl+2H2O ![]() Cl2↑+H2↑+2NaOH,产生0.2mol NaOH时,则生成0.1mol氢气,所以能收集到标准状况下的H22.24L;
Cl2↑+H2↑+2NaOH,产生0.2mol NaOH时,则生成0.1mol氢气,所以能收集到标准状况下的H22.24L;
所以答案是:2.24;
(2)电解氯化钠溶液的原理方程式为:2NaCl+2H2O ![]() Cl2↑+H2↑+2NaOH,①所以取200g溶质质量分数为0.265饱和食盐水进行电解,当NaCl反应了一半时,NaCl的质量=200g×0.265×0.5=26.5g,
Cl2↑+H2↑+2NaOH,①所以取200g溶质质量分数为0.265饱和食盐水进行电解,当NaCl反应了一半时,NaCl的质量=200g×0.265×0.5=26.5g,
答:所得混合溶液中NaCl的质量为26.5g;②消耗氯化钠为 ![]() =0.453mol,所以生成氢氧化钠的质量为0.453mol×40g/mol=18.12g,放出氢气和氯气共0.453×0.5×71+0.453×0.5×2=16.534g,则NaOH的质量分数为
=0.453mol,所以生成氢氧化钠的质量为0.453mol×40g/mol=18.12g,放出氢气和氯气共0.453×0.5×71+0.453×0.5×2=16.534g,则NaOH的质量分数为 ![]() =0.099,
=0.099,
答:所得溶液中NaOH的质量分数为0.099.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭).下列说法不正确的是( )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
C.我国历史上铅的使用早于锌
D.该冶炼锌的方法属于热还原法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子式为C4H8 , 据此推测其结构和性质不可能的是( )
A.它与乙烯可能是同系物
B.一氯代物只有一种
C.分子结构中甲基的数目可能是0、1、2
D.等质量的CH4和C4H8 , 分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S ![]() 6Cu+SO2↑,对于该反应,下列说法正确的是.
6Cu+SO2↑,对于该反应,下列说法正确的是.
A.该反应的氧化剂只有Cu2O
B.Cu既是氧化产物又是还原产物
C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2mol
D.该反应中氧化产物与还原产物的质量比为1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是.
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物  的名称是2,3,4﹣三甲基﹣2﹣乙基戊烷
的名称是2,3,4﹣三甲基﹣2﹣乙基戊烷
D.![]() 与
与 ![]() 都是α﹣氨基酸且互为同系物
都是α﹣氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F路线如图: 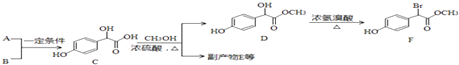
(1)A的分子式为C2H2O3 , 可发生银镜反应,且具有酸性,A所含官能团名称为: .
(2)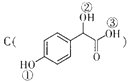 中①、②、③3个﹣OH的酸性有强到弱的顺序是: .
中①、②、③3个﹣OH的酸性有强到弱的顺序是: .
(3)E是由2分子C生成的含有3个六元环的化合物,写出E的结构简式:
(4)D→F的反应类型是 , 1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:mol.
(5)已知: ![]()
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如图: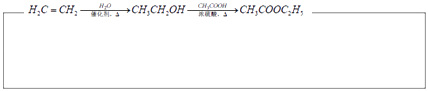
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应(反应条件略)属于取代反应的是( )
A. (NH4)2SO4+BaCl2=BaSO4↓+2NH4ClB. CH3OH+HCl→CH3Cl+H2O
C. CH2=CH2+Br2→CH2BrCH2BrD. CH3CH2OH→CH2=CH2+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com