

| 实验序号 | 盐酸体积(mL) |
| 第一组 | 19.90 |
| 第二组 | 24.70 |
| 第三组 | 20.10 |
| 第四组 | 20.00 |
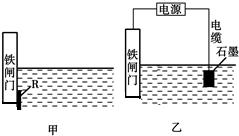
分析 (1)氢氧化钠溶液可以吸收氯气发生反应,电解池中B端为阳极生成氯气,装置B连C;依据甲装置图分析电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色;
(2)电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,据此书写电解反应;
(3)①电解氯化钠得到的是氢氧化钠溶液;
②用盐酸滴定氢氧化钠溶液,加入酚酞作指示剂,则滴定达到终点时,溶液显示中性,据此确定滴定终点;
③根据电解后得到氢氧化钠的浓度计算电解了的氯化钠的量,进而计算电解率;
④根据c(NaOH)=$\frac{c(HCl)•V(HCl)}{V(NaOH)}$分析不当操作对V(HCl)的影响,以此判断浓度的误差.
解答 解:(1)洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,氢氧化钠溶液可以吸收氯气发生反应,电解池中B端为阳极生成氯气,装置B连C,甲装置图分析电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色,电解过程中甲装置中的实验现象为:碳棒上有气泡产生,铁棒附近溶液变红,
故答案为:B;铁棒;
(2)电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,电解反应为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)①电解氯化钠得到的是氢氧化钠溶液,应选择碱式滴定管量取10.00mL电解后的溶液,加入锥形瓶中,故答案为:碱式滴定管;
②用盐酸滴定氢氧化钠溶液,加入酚酞作指示剂,滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色;故答案为:滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色;
③2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,电解消耗盐酸的体积是:$\frac{19.90+20.10+20.00}{3}$mL=20.00mL,消耗盐酸的物质的量:0.02L×0.2mol/L=0.004mol,所以100mL电解液中,电解的氯化钠物质的量为0.004mol,质量=0.004mol×58.5g/mol=0.234g,10mL溶液氯化钠溶液中含有溶质氯化钠质量=5.4mol/L×0.01L×58.5g/mol=3.159g,电解率=$\frac{0.234g}{3.159g}×100%$=7.4%;故答案为:7.4%;
④A.滴定时锥形瓶中液滴飞溅出来,则待测液的量减小,所以消耗盐酸体积减小,结果偏低,故正确;
B.滴定前读数时平视,终点读数时俯视,则消耗盐酸体积减小,结果偏低,故正确;
C.锥形瓶用蒸馏水洗净后没用待测液润洗,不影响结果,故错误;
D.酸式滴定管尖端气泡没有排除,滴定后消失,消耗盐酸体积减小,结果偏高,故错误;
故选AB.
点评 本题考查了电解原理的分析应用,电解率实验测定方案的设计方法和计算,注意金属电解后溶液中溶质成分是计算关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 解释 |
| A | SO2 | 食品漂白剂 | SO2具有还原性 |
| B | NaClO | 消毒剂 | NaClO具有强氧化性,能杀灭细菌 |
| C | Na2CO3 | 中和过多胃酸 | Na2CO3属于碱 |
| D | 浓硫酸 | 干燥剂 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
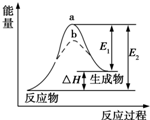
| A. | 如图可知a一定使用了催化剂 | |
| B. | 该反应为放热反应,△H=E1-E2 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 使用催化剂,可降低该反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 566kJ | B. | 283kJ | C. | 712kJ | D. | 356kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应为放热反应 | B. | 加催化剂能降低该反应焓变 | ||
| C. | A-B的键能为bkJ•mol-1 | D. | 该反应的反应热为△H=(a-b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的氢气完全燃烧分别生成气态水和液态水,前者△H大于后者 | |
| B. | 破坏反应物全部化学键所需要的能量小于破坏生成物全部化学键所需要的能量时,该反应为吸热反应 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,可知含1molH2SO4的浓硫酸与含1molNaOH的烧碱溶液混合,放出热量等于57.3kJ | |
| D. | H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水可制得金属钠 | |
| B. | 工业上用焦炭在高温下还原二氧化硅可制得粗硅 | |
| C. | 高炉炼铁的主要反应是高温下焦炭和氧化铁直接作用炼出铁 | |
| D. | 不通过化学变化就可以从海水中提取溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,则水热反应可以降低自然界中碳的含量 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,则PM2.5在空气中有可能形成胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com