
【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
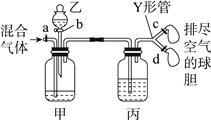
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知草酸H2C2O4是二元弱酸。室温下向10 mL 0.01 mol·L-1 H2C2O4溶液中逐滴加入0.01 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
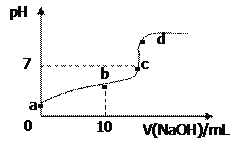
A. a点pH>2
B. b点表示的溶液中c(C2O42-)>c(H2C2O4)
C. c点时加入NaOH溶液的体积为20mL
D. d点存在c(Na+)+c(H+)=c(OH-)+2c(C2O42-)+c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶的一种合成路线如下:
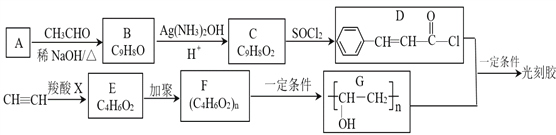
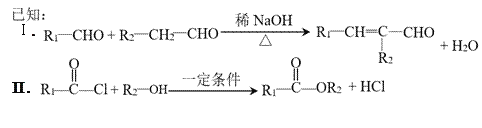
Ⅲ.RCOOH+CH![]() CH
CH![]() RCOOCH=CH2
RCOOCH=CH2
回答下列问题:
(1)A的名称是_______。C中所含官能团的名称是______。
(2)C→D的反应类型是___________,X的结构简式为___________。
(3)D+G→光刻胶的化学方程式_______________________________。
(4)T是C的同分异构体,T具有下列性质或特征:
①能发生水解反应和银镜反应;
②能使溴水褪色;
③属于芳香族化合物。则T的结构有_________种。其中核磁共振氢谱为5组峰,且峰面积比为1∶1∶2∶2∶2的结构简式为___________________________。
(5)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2COOH的合成路线流程图(无机试剂任用)_________________________。
(合成路线流程图示例如下:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
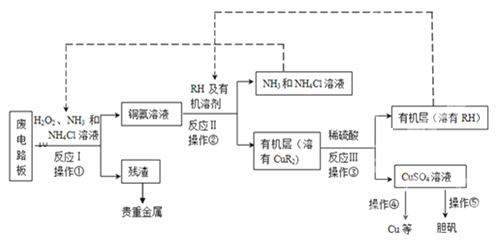
回答下列问题:
(1)反应I是将Cu转化为Cu(NH3)42+,反应中H2O2 的作用是_________________。请写出操作①的名称:________________。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,请写出该反应的离子方程式:_________________。操作②用到的主要仪器名称为___________,其目的是(填序号)__________。
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应III除了生成CuSO4之外,还生成另外一种产物是___________。
(4)操作④以石墨作电极电解CuSO4溶液,电解时的总反应式为________________。操作⑤由硫酸铜溶液制胆矾的主要步骤是___________________________________。
(5)流程中有三次实现试剂的循环使用,已用虚线标出两处,第三处的试剂是______。循环使用的NH4Cl在反应I中的主要作用是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法不正确的是( ) 
A.气体A是NO
B.X中不能确定的离子是 A13+和C1ˉ
C.溶液E和气体F能发生化学反应
D.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g) ![]() O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
C.氢气的燃烧热为241.8 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是( )
A. 铁、金属活动性顺序 B. 金、质量守恒定律
C. 银、质量守恒定律 D. 铜、金属密度顺序
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】〔化学-化学与技术〕
工业中以铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)为原料冶炼铝过程如图所示:

(1) 实验室进行过滤用到的玻璃仪器有烧杯、_____________、_____________。
(2) 操作II中生成不溶物C的离子方程式是 。
(3) 氧化铝的熔点高达2050℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是 。
(4) 电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是 。
(5) 为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示:
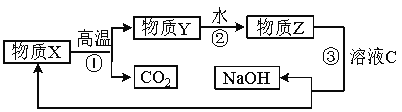
① 上述转化中未涉及四种基本反应类型中的 反应;
② 写出过程③的化学方程式: 。
(6) 研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com