
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.3mol NF3与水完全反应生成HF、HNO3和NO,转移电子数2NA
B.22.4L CO2与过量的Na2O2反应,转移的电子数为NA
C.60 g SiO2晶体中含有2 NA个Si-O键
D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA
A
【解析】
试题分析:A.NF3与水完全反应生成HF、HNO3和NO,反应方程式是:3NF3+5H2O == 9HF+HNO3+2NO,根据电子转移数目相等可知,3mol NF3反应转移电子数2NA,正确;B.影响气体体积大小的因素有物质的量和外界条件,只有条件而无条件,不能确定气体的物质的量的多少,因此不能确定其反应转移的电子数,错误;C.SiO2的摩尔质量是60g/mol,所以60 g SiO2晶体中含有4 NA个Si-O键,错误;D.常温下,Fe遇浓硝酸会发生钝化,因此不能确定5.6g铁钉与足量浓硝酸反应,转移的电子数的多少,错误。
考点:考查阿伏加德罗常数的计算的知识。


科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第三次月考化学试卷(解析版) 题型:选择题
在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是
A.氯水 B.溴水 C.碘水 D.碘化钠溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:选择题
相同质量的SO2和SO3,下列关系正确的是
A.含氧原子个数比为2:3
B.含硫元素质量比为4:5
C.含氧元素质量比为5:6
D.含硫原子个数比为1:1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:填空题
(本题共12分)氰酸(化学式:HOCN)是一种有挥发性和腐蚀性的液体,在水中立刻发生如下反应形成盐X(俗名碳铵):HOCN + 2H2O → X。
23.在上述反应所涉及的各元素中,半径最大的元素原子核外电子共占据_______个轨道。
24.能说明氮元素的非金属性比碳元素强的事实是_________(选填编号)。
A.共用电子对偏向:H-N>H-C B.氧化性:NO2>CO2
C.酸性:HNO3>H2CO3 D.沸点:NH3>CH4
25.据测定,氰酸有两种结构,一种分子内含有叁键,称为正氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出正氰酸和异氰酸的结构式:_______________、______________。
26.下面是工业上冶炼Cr时会涉及到的反应:
CrO42-+ S+ H2O → Cr(OH)3↓+ S2O32-+
(1)请将方程式补充完整并配平。
(2)上述反应中,若转移了3mol电子,得到的还原产物是 mol。
27.铁和镍(Ni)位于周期表的同一周期同一族,铁和镍在 周期 族。
28.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150℃时,Ni(CO)4分解为Ni和CO。Ni(CO)4是 晶体,Ni(CO)4易溶于下列 (填序号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z板上有H2放出,若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子,则这四种金属的活动性由强到弱的顺序为
A.X > Z > Y > M B.X > Y > Z > M
C.M > Z > X > Y D.X > Z > M > Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
用短线“-”表示共用电子对,用“‥”表示未成键孤对电子的式子叫路易斯结构式。以下路易斯结构式表示的分子属极性分子的是
①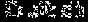 ②.
②. ③.
③. ④.
④.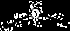
A.①②③④ B.①②③ C.②③④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三12月月考理综化学试卷(解析版) 题型:填空题
(10+2分)硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:

已知几种盐的溶解度随温度变化的曲线如图所示:

回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品Ⅰ的化学反应方程式为 ;实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有 。
(3)为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 ,洗涤干燥。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:选择题
将铁棒与石墨棒用导线连接后浸入0.01 mol·L-1食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出Cl2 D.石墨棒上放出O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,进行如下实验:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适量的稀硫酸,溶液立即变蓝;
(1)写出实验①中发生反应的离子方程式 。
实验②:取适量实验①后的溶液,滴加4 mL 0.5 mol·L—1的亚硫酸钠溶液,蓝色恰好完全褪去。
(2)实验②化学反应中转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
实验③:取适量实验①后的溶液,继续滴加次氯酸钠溶液,溶液由蓝色变为无色,生成物之一为食盐加碘的原料。
(4)写出实验③中发生反应的离子方程式 。
(5)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-= Cu2+,还原反应式:2Fe3++2e-= 2Fe2+。据此,将反应2Al+2OH—+2H2O = 2AlO2—+3H2↑拆写为两个“半反应式”:氧化反应式: ,还原反应式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com