
| A. | 分子的稳定性与化学键的强弱无关 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成水的总能量 | |
| C. | 断开参加反应的氢气和氧气中的化学键吸收的能量大于生成水时形成化学键放出的能量 | |
| D. | 该反应需要点燃,所以是吸热反应 |
分析 A.当物质发生变化时,存在化学键的断裂或生成;
B.反应物总能量高于生成物,反应放热;
C.反应中断裂化学键吸收的能量低于形成化学键放出的能量,反应放热;
D.氢气在氧气中燃烧是放热反应.
解答 解:A.当物质发生变化时,存在化学键的断裂或生成,与化学键有关,故A错误;
B.反应是放热反应,依据反应前后能量守恒得到,反应物总能量高于生成物,故B正确;
C.反应是放热反应,所以反应中断裂化学键吸收的能量低于形成化学键放出的能量,故C错误;
D.氢气在氧气中点燃发生燃烧,是放热反应,故D错误.
故选B.
点评 本题考查了化学反应能量变化分析,主要是能量守恒和反应实质的理解应用,题目较简单.


科目:高中化学 来源: 题型:填空题
| 微粒 | ClO- | ClO2- | ClO3- | ClO4- |
| 立体结构 | 直线 | V型 | 三角锥形 | 正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
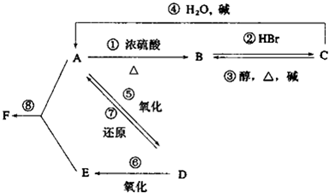 某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A.它们的转化关系如图:
某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A.它们的转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
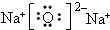 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
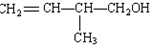
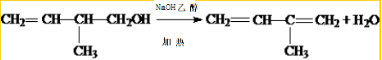 .
.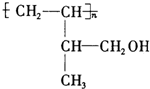 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A.NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
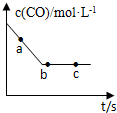 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 探究温度对反应速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com