
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 26.01 |
| 第二次 | 20.00 | 1.56 | 30.30 |
| 第三次 | 20.00 | 0.22 | 26.21 |
分析 (1)含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,甲同学运用沉淀法测定样品中NaOH的含量,溶解后加入绿化比溶液完全沉淀硫酸根离子,过滤洗涤称量沉淀质量和样品质量得到质量分数;
(2)①根据锥形瓶中溶液颜色变化判断终点;滴定前锥形瓶中为氢氧化钠和甲基橙,溶液为黄色,达到终点时变为橙色;
②根据C(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
③由图可知滴定前读数为0.00mL,滴定后为26.10mL;
(3)第二次实验数据误差太大,舍去,求出第一、三次实验的平均值,再根据 C(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$计算出C(待测),V(标准)用两次的平均值,然后根据n=cV和m=nM计算1000mL烧碱样品中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数.
解答 解:(1)含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,甲同学运用沉淀法测定样品中NaOH的含量,溶解后加入氯化钡溶液完全沉淀硫酸根离子,过滤洗涤称量沉淀质量和样品质量得到质量分数;
故答案为:氯化钡溶液;样品质量和沉淀的质量;
(2)①滴定时要根据锥形瓶中溶液颜色变化判断终点,所以眼睛应该观察锥形瓶内溶液颜色变化;滴定前锥形瓶中为氢氧化钠和甲基橙,溶液为黄色,达到终点时变为橙色,则滴定终点的现象是溶液由黄色变成橙色,且半分钟不褪色;
故答案为:锥形瓶内溶液颜色变化;由黄色变成橙色,且半分钟不褪色;
②根据C(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$分析,
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成消耗的V(标准)偏大,则测定c(NaOH)偏高,故A不符合;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,测定c(NaOH)无影响,故B不符合;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,测定c(NaOH)偏高,故C不符合;
D.读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,测定的c(NaOH)偏低,故D符合;
故答案为:D;
③由图可知滴定前读数为0.00mL,滴定后读数为26.10mL;
故答案为:0; 26.10;
(3)第二次实验数据误差太大,舍去,求出第一、三次实验的平均值为$\frac{26.01+(26.21-0.22)}{2}$=26.00mL,
则C(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.1000mol/L×26.00}{20.00}$=0.13mol/L,
则1000ml溶液中氢氧化钠为n=cV=0.13mol/L×1L=0.13mol,
所以m(NaOH)=nM=0.13mol×40g/mol=5.2g,
该样品中NaOH的质量百分含量为$\frac{5.2g}{5.360g}$×100%=97.01%;
答:该样品中NaOH的质量百分含量为:97.01%.
点评 本题主要考查了中和滴定操作、误差分析以及烧碱的纯度的计算,难度中等,注意知识的积累,侧重于考查学生的实验能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
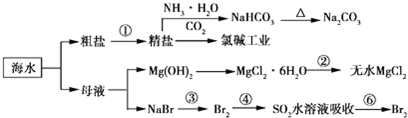
| A. | 电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用 | |
| B. | 联合制碱法最终副产物为氯化铵,原子利用率小于100% | |
| C. | 步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁 | |
| D. | 海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其褪色原理相同 | |
| B. | Y与乙酸反应生成W的反应类型是取代反应 | |
| C. | Z和Y分子中官能团不同 | |
| D. | W的分子式为C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性H2S>HCl>HBr>HI | B. | 酸性HF>HCl>HBr>HI | ||
| C. | 离子半径K+>Cl->S2->S | D. | 酸性HClO4>H2SO4>H2CO3>HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com