
����Ŀ���������ֳ����£�N2H4����ɫҺ�壩��һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϣ��ش��������⣺
��1���������ӵĵ���ʽΪ__��
��2��ʵ���ҿ��ô���������Һ�백��Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ��___��
��3����2O2(g)+N2(g)=N2O4(l) ��H1
��N2(g)+2H2(g)=N2H4(l) ��H2
��O2(g)+2H2(g)=2H2O(g) ��H3
д��������N2O4��Ϊ����ƽ�����Ӧ���Ȼ�ѧ����ʽ����H�ú���H1����H2����H3�Ĵ���ʽ��ʾ��___��
���𰸡�![]() NaClO+2NH3=N2H4+NaCl+H2O 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H=2��H3-2��H2-��H1
NaClO+2NH3=N2H4+NaCl+H2O 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H=2��H3-2��H2-��H1
��������
�������������ַǽ���Ԫ���γɵĹ��ۻ��������ÿ�����1�Ե��ӣ����͵�֮�乲��1�Ե��ӡ�
�ƴ���������Һ�백��Ӧ�Ʊ�������ClԪ�صĻ��ϼ���+1�۽��͵�1�ۣ�NԪ�صĻ��ϼ���3�����ߵ�2�ۣ����ݵ�ʧ�����غ��ԭ���غ���ƽ��
�Ǹ��ݸ�˹���ɣ�2����2���ڢ�����2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)����H��
�������������ַǽ���Ԫ���γɵĹ��ۻ��������ÿ�����1�Ե��ӣ����͵�֮�乲��1�Ե��ӣ������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�ƴ���������Һ�백��Ӧ�Ʊ�������ClԪ�صĻ��ϼ���+1�۽��͵�1�ۣ�NԪ�صĻ��ϼ���3�����ߵ�2�ۣ����ݵ�ʧ�����غ��ԭ���غ���ƽ����Ӧ�Ļ�ѧ����ʽΪNaClO+ 2NH3 = N2H4+NaCl+H2O���ʴ�Ϊ��NaClO+ 2NH3 = N2H4+NaCl+H2O��
�Ǹ��ݸ�˹���ɣ�2����2���ڢ�����2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)����H�����Է�Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H =2��H 32��H2��H1���ʴ�Ϊ��2N2H4(l)+N2O4(l)=3N2(g) + 4H2O(g) ��H=2��H 32��H2��H1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������Ԫ��A��B��C��D��E��F��ԭ��������������Aԭ�ӵ������ӵĵ����Ų�ʽ���̬����ӵ���ͬ��A��Eλ��ͬ���壬��̬Bԭ�Ӻ�����3���ܼ��Ҹ��ܼ������ɵĵ�������ȣ���̬Dԭ����2��δ�ɶԵ��ӣ������ܲ����ΪL��+1��F���ӵ�3d�ܼ��ﵽȫ�����ṹ��
�ش��������⣺
��1����̬Cԭ�Ӽ۵����Ų�ͼΪ_____��
��2��B��C��D����Ԫ�ص�һ�������ɴ�С����Ϊ_____(��Ԫ�ط��ţ���ͬ)�����ǵĵ縺����С��������Ϊ_____��
��3��C��F��ɵľ���ľ�����ͼ1��ʾ����֪�þ����ܶ�Ϊ��g��cm-3��NA���������ӵ���������C��F����ĺ˼��Ϊ_____cm��
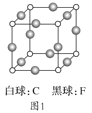
��4��A��E��ɾ��壬�侧����ͼ2��ʾ��E������Χ��_____��E���������������������E�Ⱦ����������A���ӹ��ɵ���״��_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��������һ�������ӽ���Ĥȼ�ϵ�ؿ������ô�������SO2������������װ��ʾ��ͼ��ͼ��

�����ӵ���������Ϊ________________������A��B��������B��A������
�ڸ����ĵ缫��ӦʽΪ________________��
(2)��ҵ�����պ�ת��SO2�ĵ��װ��ʾ��ͼ���£�A.B��Ϊ���Ե缫����
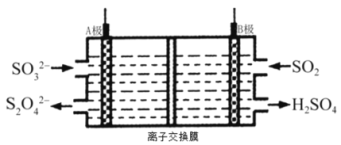
��B���ӵ�Դ��________________����������������������
��A���ĵ缫��Ӧʽ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������о�Ŀ�ĺ�ʾ��ͼ������ǣ� ��
ѡ�� | A | B | C | D |
�о�Ŀ�� | �ܱ������У�ѹǿ�Է�Ӧ��2SO2(g)+O2(g) | �̶��ݻ����ܱ������У��¶ȶԷ�Ӧ��N2(g)+3H2(g) | ������Na��K�ֱ�������ˮ��Ӧ | �̶��ݻ����ܱ������У�����CO2Ũ�ȣ����Ѵ�ƽ��ķ�Ӧ��CO(g)+H2O(g) |
ʾ��ͼ |
|
|
|
|
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����һ��Ũ�ȵ�Na2C2O4��Һ�еμ����ᣬ�����Һ��pH������Ũ�ȱ仯��ϵ��ͼ��ʾ����֪H2C2O4�Ƕ�Ԫ���ᣬX��ʾ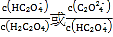 �����������������
�����������������
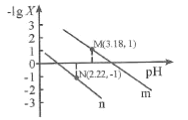
A.��M�㵽N��Ĺ����У�c(H2C2O4)������
B.ֱ��n��ʾpH��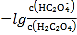 �Ĺ�ϵ
�Ĺ�ϵ
C.��N���֪Ka1 (H2C2O4)��������Ϊ10 -2
D.pH=4.18�Ļ����Һ�У�c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��10��1�գ�����ף�л���������70������ı���ʽ�ϣ���������DF-31A��ս�Ե������ҹ������λ������ʵ����������־�����������ϰ�����Fe��Cr��Ni��C�ȶ���Ԫ�ء��ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ___��
��2����Crͬ�����һ�̬ԭ��������������ͬ��Ԫ�أ�����λ�����ڱ���___����
��3��ʵ���ҳ���KSCN��Һ������(![]() )����Fe3+������N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ___(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ___��
)����Fe3+������N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ___(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ___��
��4����Ԫ������CO�γ�Fe(CO)5���ʻ���[Fe(CO)5]���������������Ϳ������ȡ�1mol Fe(CO)5�����к�___mol��������CO��Ϊ�ȵ������һ�����ӵĻ�ѧʽΪ___��
��5��̼��һ��ͬ��������ľ���ɲ�ȡ�����ܶѻ���Ȼ���ڿ�϶�в���������ӻ�ó����塣��ͼΪһ�ֳ��������������������C60����ռ�ݶ�������Ĵ���K+ռ�ݵ���C60����Χ�ɵ�___��϶��___��϶(��οռ乹��)����C60���ӵ���������ֱ�ΪA(0��0��0)��B(![]() ��0��
��0��![]() )��C(1��1��1)�ȣ������Aλ������������ӵ�ԭ���������Ϊ___��
)��C(1��1��1)�ȣ������Aλ������������ӵ�ԭ���������Ϊ___��
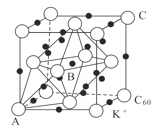
��6��Ni�����γɶ������������һ��NiaO���徧���ṹΪNaCl�ͣ����ھ���ȱ�ݣ�a��ֵΪ0.88���Ҿ����е�Ni�ֱ�ΪNi2+��Ni3+��������Ni2+��Ni3+�����������Ϊ___����������Ϊ428pm�������ܶ�Ϊ___g/cm3(NA��ʾ�����ӵ�������ֵ���г�����ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����( )
A.��Ȼ��֬���ǻ���û�к㶨���۵�ͷе�
B.�ñ���Na2CO3��Һ���Գ�ȥ���������е�����
C.![]() ������Ϊ2-�һ�����
������Ϊ2-�һ�����
D.�л���![]() ����������̼ԭ�Ӳ�������ͬһ��ƽ����
����������̼ԭ�Ӳ�������ͬһ��ƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������ұ���GB2760��2011���涨���Ѿ���SO2���ʹ����Ϊ0.25g/L��ij��ȤС����ͼ1װ�ã��г�װ���ԣ��ռ�ij���Ѿ���SO2�����Ժ������вⶨ��
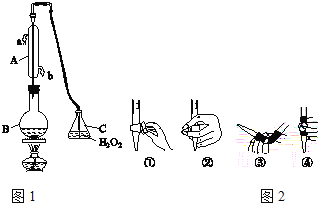
��1������A��������_____��ˮͨ��A�Ľ���Ϊ_____��
��2��B�м���300.00mL���Ѿƺ��������ᣬ����ʹSO2ȫ���ݳ�����C��H2O2��ȫ��Ӧ���仯ѧ����ʽΪ_____��
��3����ȥC�й�����H2O2��Ȼ����0.0900mol/LNaOH����Һ���еζ����ζ�ǰ������ʱ��Ӧѡ��ͼ2�е�_____�������ֱ�ţ������ζ��յ�ʱ��Һ��pH��8.8����ѡ���ָʾ��Ϊ_____������50mL�ζ��ܽ���ʵ�飬���ζ����е�Һ���ڿ̶���10�����������Һ������������ţ�__________����=10mL����=40mL����<10mL����>40mL����
��4���ζ����յ�ʱ������NaOH��Һ25.00mL�������Ѿ���SO2����Ϊ��_____g/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��NO��NO2��SO2���Ǵ�����Ⱦ�������Щ�������ŷŶ��ڻ�������������Ҫ�����塣
��֪�����Ȼ�ѧ����ʽ
C(s)+O2(g)=CO2(g) ��H1=-393.5kJ��mol-1
N2(g)+2O2(g)=2NO2(g) ��H2=+68kJ��mol-1
2C(s)+O2(g)=2CO(g) ��H3=-221.0kJ��mol-1
��1��2NO2(g)+4CO(g)=4CO2(g)+N2(g)��H=__kJ��mol-1��
��ij�¶��£���2L�ܱ������г���0.4mo1CO��0.6molNO2����ʱ������ѹǿΪ2.0��105Pa��5sʱ��������ѹǿ��Ϊԭ����0.95������ӷ�Ӧ��ʼ��5��ĩNO2��ƽ����Ӧ����v(NO2)=__mol/(L��s)��
��������ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����__��
A.�ʵ������¶�
B.��С�������ʹ��ϵѹǿ����
C.��ʱ�����CO2
D.���ܱ��������ٳ���0.4molNO2
��2��ij�¶��£����з�Ӧ��ƽ�ⳣ�����£�
a.2NO2(g)N2(g)+2O2(g) K1=7.0��1016
b.2NO(g)N2(g)+O2(g) K2=2.1��1030
��Ӧ2NO(g)+O2(g)2NO2(g)��ƽ�ⳣ��K3=__��
��3���ڴ�����������CO��ԭNO2����β��������
����ͬ�����£�ѡ��A��B��C���ִ������з�Ӧ������N2�����ʵ�����ʱ��仯��ͼa�������С����_(��E(A)��E(B)��E(C)��ʾ���ִ����¸÷�Ӧ���)��

���ڴ���B�����£������ͬʱ���ڣ�����NO2�������¶ȵĹ�ϵ��ͼb��ͼ��������������С����˵�����С��ԭ��___(������¶ȷ�Χ�ڴ�Ч����ͬ)��

��4��úȼ�ղ�����SO2��NaOH��Һ���գ������õ�Na2SO3��Һ���е�⣬�����Ʊ�H2SO4����ԭ����ͼc��ʾ(�缫����Ϊʯī)��a�缫��ӦʽΪ__��bΪ_(������)����d���ӽ���ĤΪ__(������)���ӽ���Ĥ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com