
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
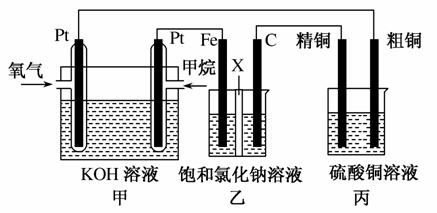
(1)甲烷燃料电池负极反应式是__________________。
(2)石墨(C)极的电极反应式为__________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L;丙装置中阴极析出铜的质量为________g。
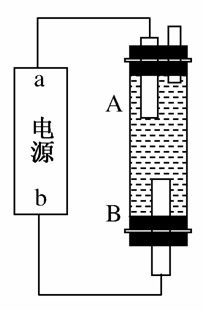
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用________。
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
解析 (1)甲烷燃料电池负极上发生氧化反应,即甲烷在负极上被氧化。在KOH溶液中甲烷被氧化的产物为碳酸钾,负极反应式为CH4-8e-+10OH-===CO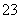 +7H2O。(2)原电池的负极与电解池的阴极相接,铁极为阴极,则C极为阳极,在C极上发生氧化反应,电极反应式为2Cl--2e-===Cl2↑。(3)n(O2)=
+7H2O。(2)原电池的负极与电解池的阴极相接,铁极为阴极,则C极为阳极,在C极上发生氧化反应,电极反应式为2Cl--2e-===Cl2↑。(3)n(O2)=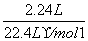 =0.1 mol,甲池中正极反应式为O2+4e-+2H2O===4OH-,由电子守恒知,经过甲、乙、丙装置的电子的总物质的量为0.4 mol。乙池中的铁极与甲池的负极相连,铁极为阴极,发生还原反应,电极反应式为2H2O+2e-===2OH-+H2↑,n(H2)=
=0.1 mol,甲池中正极反应式为O2+4e-+2H2O===4OH-,由电子守恒知,经过甲、乙、丙装置的电子的总物质的量为0.4 mol。乙池中的铁极与甲池的负极相连,铁极为阴极,发生还原反应,电极反应式为2H2O+2e-===2OH-+H2↑,n(H2)=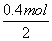 =0.2 mol,V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。丙池中精铜为阴极,发生还原反应,电极反应式为Cu2++2e-===Cu,n(Cu)=
=0.2 mol,V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。丙池中精铜为阴极,发生还原反应,电极反应式为Cu2++2e-===Cu,n(Cu)=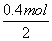 =0.2 mol,m(Cu)=0.2 mol×64 g·mol-1=12.8 g。(4)漂白液的有效成分是次氯酸盐,制备原理是2Cl-+2H2O
=0.2 mol,m(Cu)=0.2 mol×64 g·mol-1=12.8 g。(4)漂白液的有效成分是次氯酸盐,制备原理是2Cl-+2H2O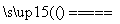 2OH-+Cl2↑+H2↑,Cl2+2OH-===Cl-+ClO-+H2O,气体与液体反应,最好采用逆向接触,即气体在下端产生,碱溶液在上端生成,使其充分反应,所以该装置的下端为阳极,上端为阴极,阴极与电源负极相连,故a极为负极。生活中常见且廉价的氯化物是氯化钠,故电解质溶液最好用饱和氯化钠溶液。若制备氢氧化亚铁,用硫酸钠溶液作电解质溶液,选用铁作阳极。
2OH-+Cl2↑+H2↑,Cl2+2OH-===Cl-+ClO-+H2O,气体与液体反应,最好采用逆向接触,即气体在下端产生,碱溶液在上端生成,使其充分反应,所以该装置的下端为阳极,上端为阴极,阴极与电源负极相连,故a极为负极。生活中常见且廉价的氯化物是氯化钠,故电解质溶液最好用饱和氯化钠溶液。若制备氢氧化亚铁,用硫酸钠溶液作电解质溶液,选用铁作阳极。
答案 (1)CH4-8e-+10OH-===CO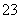 +7H2O
+7H2O
(2)2Cl--2e-===Cl2↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是( )
|
| A. | 钠保存在煤油中 |
|
| B. | 用棕色试剂瓶盛放新制的氯 |
|
| C. | 用带玻璃塞的试剂瓶盛放NaOH溶液 |
|
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况.
| 步骤 | 操作 | 现象 |
| I | 向2mL 1mol•L﹣1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH 7(填“<”、“>”或“=”).
(2)分析红褐色产生的原因.
①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因: .
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
□Fe3++□SO32﹣+□ ═□Fe2+□ +□
乙同学查阅资料得知:
| 1.Fe2+与SO32﹣反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色. |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3.而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是 .
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1mol•L﹣1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是 (填字母).
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因: .
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确.
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。某科研小组用该原理处理污水,设计的装置如图所示。下列说法正确的是( )
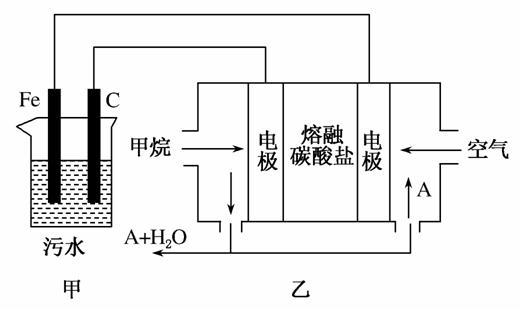
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-===Fe3+
C.为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
D.当乙装置中有1.6 g CH4参加反应时,C电极理论上生成气体的体积在标准状况下为4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
应用所学知识回答下列问题:
(1)下列叙述中,正确的是________。
A.蚕丝、棉花和羊毛的主要成分都是纤维素
B.我们所吃的豆腐中主要含有蛋白质
C.“非典”元凶冠状病毒是一种油脂
D.生物实验室用福尔马林(40%的甲醛溶液)保存生物标本
(2)蛋白质水解的最终产物是________。
(3)下列有关说法正确的是________。
A.蛋白质中只含C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.糖类并不都有甜味
D.糖类、油脂、蛋白质都能发生水解反应
(4)淀粉溶液和蛋白质溶液都是胶体,用一束光通过其溶液,都产生________现象,若检验它们可选用的试剂是________。
(5)血液中有一种含铜的呈蓝色的蛋白质分子,其相对分子质量约为151 000。已知该分子中铜的质量分数为0.34%,则平均每个铜蓝蛋白质分子中的铜原子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某质检员将甲、乙、丙三种衣料做纤维检验,所得结果如下表:
| 甲 | 乙 | 丙 | |
| 靠近火焰 | 稍微卷缩 | 无变化 | 尖端熔成小球 |
| 燃烧的气味 | 有特殊气味 | 无异味 | 有味 |
| 热塑性 | 无 | 无 | 良好 |
检验甲、乙、丙三种衣料纤维后得出的最佳结论是( )
A.甲为棉、乙为丝,丙为涤纶
B.甲为丝、乙为棉,丙为腈纶
C.甲为腈纶、乙为丝,丙为棉
D.甲为棉、乙为维尼纶,丙为丝
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的操作及描述不正确的是( )
|
| A. | 粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 |
|
| B. | 用托盘天平称取10.5 g NaCl时应在右边托盘中放入10 g砝码 |
|
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
|
| D. | 测定溶液pH的操作将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,然后与标准比色卡对照 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com