
【题目】将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积和剩余的2mL气体可能分别是
A.1.2mL,NOB.2.4mL,O2
C.3.5mL,O2D.4mL,NO
【答案】A
【解析】
NO2和O2的混合气体溶于水发生的反应为:4NO2+O2+2H2O=4HNO3,
若剩余2 mL气体为O2,则发生该反应的气体体积为10 mL,其中NO2是8 mL,O2是2 mL,因此原混合气体中NO2体积为8mL,O2的体积为2 mL+2 mL=4 mL;
若剩余气体为NO气体,根据3NO2+H2O=2HNO3+NO,可知过量的NO2体积为3×2 mL=6 mL,则发生反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为12 mL-6 mL=6 mL,其中反应消耗的氧气为6 mL×![]() =1.2 mL,NO2的总体积为12 mL-1.2 mL=10.8mL。
=1.2 mL,NO2的总体积为12 mL-1.2 mL=10.8mL。
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年我国废旧锂离子电池的产生将达到爆发期,某高校实验室利用废旧钴酸锂正极片进行钴酸锂的再生工艺设计如下,请回答下列问题:
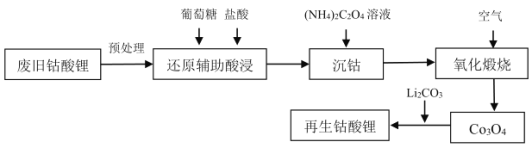
(1)拆解废旧电池前需要进行放电,以避免在拆解过程中因局部短路起火,放电方式为电化学放电,可以将废旧电池浸泡在_____________中进行放电。
A.酒精 B.98%H2SO4C.Na2SO4溶液
(2)预处理时,钴酸锂(Li0.5CoO2)高温下分解得到LiCoO2、Co3O4和一种气体,该反应的化学方程式为_________________。
(3)已知难溶物CoC2O4的Ksp=4.0×10-6,一般认为离子浓度达到10-5mol/L时即完全除尽。沉钴过程中,当Co2+完全沉淀时,溶液中![]() 的浓度至少为_________mol/L。
的浓度至少为_________mol/L。
(4)沉钴过程中,草酸盐体系中钴离子形态分布如图,在不同pH范围钴离子形态不同的原因___________________。

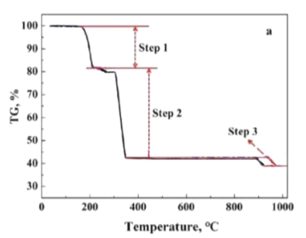
(5)在空气氛围下CoC2O42H2O氧化分解制备Co3O4的失重曲线如图所示,已知![]() 失重率大约为19.7%;
失重率大约为19.7%;![]() 失重率大约为36.3%;
失重率大约为36.3%;![]() 失重率大约为3.0%。请写出
失重率大约为3.0%。请写出![]() 发生的化学反应方程式______________________。
发生的化学反应方程式______________________。
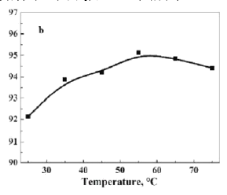
(6)已知生成草酸钴的过程为吸热过程。在![]() ,沉淀时间
,沉淀时间![]() ,考察温度对Co2+沉淀率的影响,结果如图所示,沉淀率呈先增大后减小的趋势的原因可能____________。
,考察温度对Co2+沉淀率的影响,结果如图所示,沉淀率呈先增大后减小的趋势的原因可能____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在有机合成中被称为“万能还原剂”。制备硼氢化钠的流程如图:
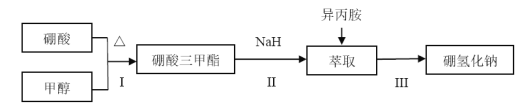
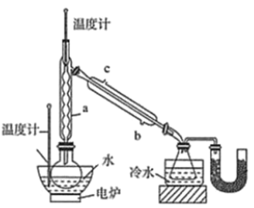
硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图所示(夹持装置略去,下同)。
硼酸三甲酯B(OCH3)3 | 甲醇 | 甲醇钠 | |
溶解性 | 与乙醇、甲醇混溶,能水解 | 与水混溶 | 溶于甲醇,不溶于异丙胺 |
沸点/℃ | 68 | 64 | 450 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | |||
(1)直形冷凝管冷却水应从________(填“b”或“c”)接口进入。
(2)浓硫酸的作用是_______。
(3)本实验采用水浴加热,优点是________;U型管中试剂的作用是__________。
(4)在240℃条件下进行,硼酸三甲酯与氢化钠反应制取NaBH4,同时生成CH3ONa,写出该反应的化学方程式______。
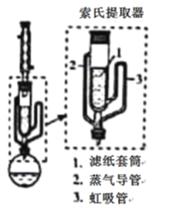
(5)萃取时可采用索氏提取法,其装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。当萃取完全后,硼氢化钠在_______(填“圆底烧瓶”或“索氏提取器”)中。
(6)分离NaBH4并回收溶剂,采用的方法是_______。
(7)“有效氢含量”可用来衡量含氢还原剂的还原能力,定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_____________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓝矾(CuSO4·5H2O)常作杀菌剂。某小组设计如图1装置制备蓝矾,实验原理: Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。
操作步骤:向三颈瓶加入3.2 g Cu粉和适量稀硫酸及30 mL 1 mol·L-1 CuCl2溶液,利用二连球向三颈瓶中鼓入空气,铜溶解。当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸,得到蓝矾(不考虑氯化铜转化成硫酸铜)。下列说法正确的是

A.盛装CuCl2溶液的仪器是长颈漏斗B.在实验过程中,浓硫酸作氧化剂
C.采用重结晶法提纯CuSO4·5H2OD.理论上可以制备20 g CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功地在铁掺杂W18O49纳米催化剂表面常温下获得较高的氨产量,反应历程如图所示(★表示被吸附在催化剂表面的物种)。下列说法错误的是
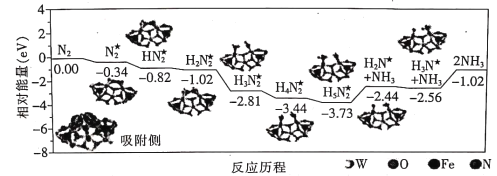
A.需要吸收能量的最大能垒(活化能)E=1.54eV
B.吸收能垒为1.29 eV步骤的反应为H5N2★=NH3+H2N★
C.选择镍掺杂W18O49纳米催化剂获得反应历程与上述不同
D.投料比[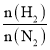 ]越大,单位时间内合成氨的产量越高
]越大,单位时间内合成氨的产量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然油脂的分子式为C57H106O6。1 mol该油脂水解可得到1 mol甘油、1 mol脂肪酸X和2 mol直链脂肪酸Y。经测定X的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。下列说法错误的是( )
A.X的分子式为C18H32O2
B.脂肪酸Y能发生取代反应
C.Y的结构简式可能为CH3CH=CH(CH2)14COOH
D.Y的结构简式为CH3(CH2)16COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C-C可以绕键轴旋转,结构简式为下图的烃,下列说法正确的是:
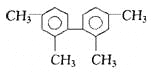
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.该烃的一氯取代物最多有3种
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其它条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.全部B.①③④⑤C.②③④⑤⑦D.③⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com