
分析 (1)根据已知反应和目标反应,利用盖斯定律可知反应C3H8(g)→CH3CH=CH2(g)+H2(g)由已知的反应相减得到,则△H=△H1-△H2;
(2)H2CO3?HCO3-+H+的平衡常数Ka=$\frac{c({H}^{+})×c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$,利用忽略水的电离及H2CO3的第二级电离,由溶液的pH=5.60可知c(H+),然后代入计算;
(3)NaHCO3溶液的pH大于8,则水解大于电离,水解生成H2CO3,电离生成CO32-.
解答 解:(1)由C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1①,
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ•mol-1 ②,
则根据盖斯定律,反应C3H8(g)→CH3CH=CH2(g)+H2(g)可由①-②得到,
所以△H=△H1-△H2=+156.6kJ•mol-1-(+32.4kJ•mol-1)=+124.2kJ•mol-1,故答案为:+124.2;
(2)忽略水的电离及H2CO3的第二级电离,pH=5.60,c(H+)=10-5.60=2.5×10-6mol•L-1,
由H2CO3?HCO3-+H+,
平衡时c(H+)=c(HCO3-)=2.5×10-6mol•L-1,
c(H2CO3)=(1.5×10-5-2.5×10-6)mol•L-1,
则Ka=$\frac{c({H}^{+})×c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=4.2×10-7 mol•L-1,故答案为:4.2×10-7 mol•L-1;
(3)NaHCO3溶液的pH大于8,则水解大于电离,水解生成H2CO3,电离生成CO32-,即HCO3-?CO32-+H+,HCO3-+H2O?H2CO3+OH-,
所以c(H2CO3)>c(CO32-),故答案为:>;HCO3-?CO32-+H+,HCO3-+H2O?H2CO3+OH-,H$C{O_3}^-$的水解程度大于电离程度.
点评 本题考查了多个知识点,属于小综合习题,明确盖斯定律、电离平衡常数的计算、溶液中利用电离与水解来比较离子的浓度即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
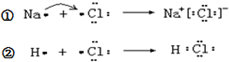 下列说法不正确的是( )
下列说法不正确的是( )| A. | ①和②变化过程中都会放出热量 | |
| B. | 氯原子吸引电子的能力强于钠原子和氢原子 | |
| C. | NaCl中含有离子键,HCl中含有极性共价键 | |
| D. | ①和②中的氯原子均得到1个电子达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑧ | B. | ①③④⑤⑧ | C. | ①③④⑧ | D. | 以上均不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0△S>0的反应均是自发反应 | |
| B. | 自发进行的反应一定能迅速进行 | |
| C. | 冰在室温下自动熔化成水,不是熵增的结果 | |
| D. | 非自发进行的反应一定不可能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件,该小组同学为探究中毒原因进行了如下实验:
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件,该小组同学为探究中毒原因进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 发展阶段 | 原子结构模型 | 重要科学家 | 提出模型的主要依据 |
| (1) | 近代原子论 | 气体实验与观察 | |
| (2) | 汤姆孙 | ||
| (3) | 原子行星模型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com