
 .
. 分析 (1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
氢氧化铝与盐酸反应生成氯化铝和水;
(2)反应中碳元素由-4价升高到二氧化碳中+4价,失去8个电子,氧原子得到8个电子生成-2价氧.
解答 解:(1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,离子方程式:HCO3-+H+=CO2↑+H2O;
故答案为:HCO3-+H+=CO2↑+H2O;
氢氧化铝与盐酸反应生成氯化铝和水,离子方程式:Al(OH)3+3H+=Al3++3H2O;
故答案为:Al(OH)3+3H+=Al3++3H2O;
(2)反应中碳元素由-4价升高到二氧化碳中+4价,失去8个电子,氧原子得到8个电子生成-2价氧,用双线桥表示为: ;
;
故答案为: .
.
点评 本题考查了离子方程式书写、氧化还原反应单线桥表示方法,明确反应实质、氧化还原反应中元素化合价变化及单先桥表示注意事项是解题关键,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
 向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m 与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法不正确的是( )
向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m 与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法不正确的是( )| A. | O→a时的反应的离子方程式为:Ba2++2OH-+SO42-+Mg2+═BaSO4↓+Mg(OH)2↓ | |
| B. | a→b时发生的离子反应为H++OH-=H2O | |
| C. | 从a→b→c说明溶液中结合OH-的能力强弱为:H+>Mg2+ | |
| D. | 原混合溶液中 C(HCl):C(MgSO4)=4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 实验③中反应的离子方程式为2Fe+Fe3+═3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
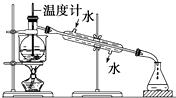 (1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.
(1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢气的燃烧 | B. | 水的电解 | C. | 甲烷的燃烧 | D. | 一氧化碳的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
.某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 132 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 与水反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com