
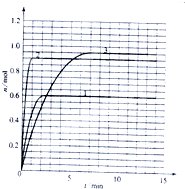
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
 2Z.
2Z.| △c |
| △t |
| 转化了的物质的量 |
| 起始总物质的量 |
| 转化了的物质的量 |
| 起始总物质的量 |
| 实际产量 |
| 理论产量 |
| 平衡时Y的物质的量 |
| 平衡时体系气体总物质的量 |
 ,
, ;
; 2Z,
2Z, 2Z;
2Z;
| ||
| 3min |
| 0.7 |
| 1.0 |
| 0.45 |
| 1.0 |
| 0.9 |
| 1.0 |
| 0.1 |
| 1.55 |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
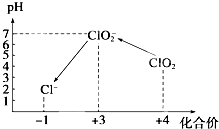 ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成纤维与人造纤维可以统称为化学纤维 |
| B、酚醛树脂和聚氯乙烯都是热固性塑料 |
| C、天然橡胶的化学组成是聚异戊二烯 |
| D、复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单一材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL 4 mol?L-1 NaCl溶液 |
| B、75 mL 1 mol?L-1 AlCl3溶液 |
| C、50 mL 2 mol?L-1 CaCl2溶液 |
| D、200 mL 2 mol?L-1 KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15s | B、20s |
| C、48s | D、20s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀硫酸 |
| 氧化铜 |
| 稀硫酸 |
| 铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com